哈佛大学医学院《Science》子刊:利用3D打印治疗钙化主动脉瓣病(2)
时间:2024-03-13 11:41 来源:EngineeringForLife 作者:admin 阅读:次
【EV载体蛋白质组学研究发现CAVD病理中的差异负载】
有证据表明,EV在动脉粥样硬化和CAVD(钙化性心血管疾病)中发挥着基础性作用。为了评估EV在体外CAVD建模中的作用,本研究进行了EV载体蛋白质组学分析。本研究分离了EV并通过纳米粒子追踪分析确定了适当的大小范围。对分离的EV进行的蛋白质组学分析鉴定出了1300多种蛋白质,其中包括26种常见的EV标记物(图5A)。主成分分析显示了模型和培养基标记的EV蛋白质组之间的明显聚类(图5B和C)。与细胞蛋白质组学分析不同,所有培养基条件(NM、OM、PM)在体外模型之间产生了类似数量的差异EV载体蛋白质(图5E)。然而,总体上EV蛋白质组更加稳定:在任何体外模型的任何培养基处理中,只有平均5%(977个蛋白质中的42个)的总蛋白质丰度存在差异(图5E),而在NM条件下细胞蛋白质组中有15%存在差异(图3H)。在2D和3D模型中,所有差异的EV载体蛋白质中,仅有不到4%在不同培养基处理之间共享,这表明每种培养基和模型都具有独特的负载响应(图5F至H)。在2D NM模型中,与EV载体的关键差异与整合素介导的信号传导(CD63、FLNA、FERMT2和FERMT3)以及线粒体膜相关的凋亡(YWHA家族)有关(图5F)。OM EV载体差异与超氧化物调节(PRDX2、APOA4和SOD2)以及细胞外基质组装(TNXB、PXDN、LAMB1和EMILIN1)有关(图5G)。最后,PM EV载体的变化与纤溶酶原(ENO1和THBS1)以及细胞外基质(VIM、MFAP4和EMILIN1)有关(图5H)。
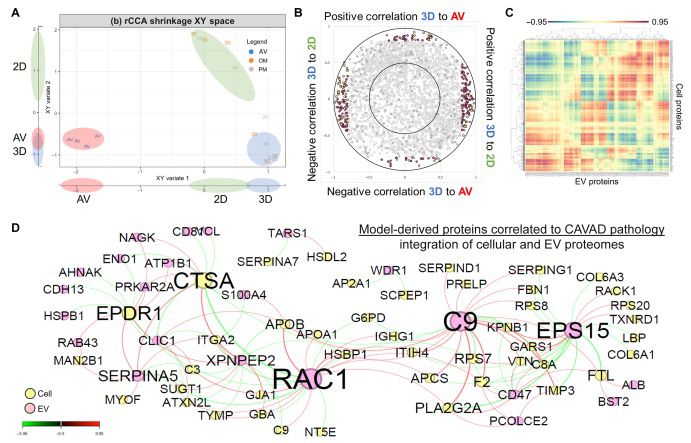
图5 EV蛋白质组学鉴定了基质依赖的物质加载和普遍存在的与主动脉瓣相关的物质
【多层次组学数据集的整合显示了CAVD重现的关键驱动因素】
在深入描述细胞和EV蛋白质组中的差异丰度模式后,本研究的目标是研究这些蛋白质组之间的关联模式,以确定在不同刺激条件下3D打印水凝胶模型和2D培养条件中重现CAVD病理的蛋白质。为此,本研究利用了两种计算分析方法:正则化典型相关分析(rCCA)(图6)和用于单个样本的线性插值网络估计(LIONESS)(图7),每种方法阐明了不同的关联方面。首先,本研究旨在检查细胞和EV数据集中的哪些蛋白质推动了体外钙化模型和原发性CAVD组织的重现。本研究使用rCCA来识别正交分量或变量之间的最大相关性(图6A至D)。典型分量1显示了2D和3D体外模型之间的高相关性,而典型分量2显示了3D模型和CAVD组织之间的高相关性(图6A)。相关圆圈图用于可视化典型分量之间的关系,其中每个点代表细胞或EV蛋白质组中的一个蛋白质(图6B)。通过对这些数据进行阈值处理,本研究确定与每个典型分量显著相关的蛋白质(图6B和C)。本研究观察到了具有相同类型相关性的变量(蛋白质)的子集簇(图6C)。与之相对应的相关网络显示了推动钙化水凝胶和CAVD组织之间相关性的细胞和EV载体蛋白质(图6D)。本研究发现,虽然EV蛋白质占两个数据集的比例不到10%,但它们占据了推动CAVD和体外模型中钙化的蛋白质的30%以上。在被确定为与CAVD组织重现钙化模型的98%的蛋白质(65个中的64个,P < 0.05,根据精确二项检验)之前已被认为与心血管疾病有关(PheGenI,美国国家生物技术信息中心)。这些综合的多层次蛋白质组学分析方法确定了钙化的已知和未知驱动因素,并确定了这种3D水凝胶模型在体外重现CAVD疾病方面的改进。
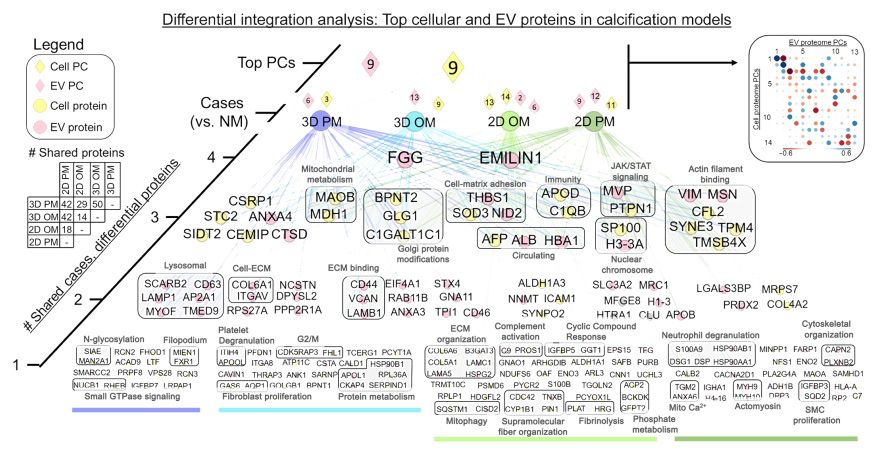
图6 通过整合细胞和EV载体衍生的蛋白质组,对钙化模型中疾病重现的网络分析进行了研究
最后,本研究旨在利用多组学整合和系统生物学方法,确定在这些模型中与钙化有关的已知和未知蛋白质。图7中显示的网络是由三种类型的节点构成的顶部加载信息:比较钙化模型(案例和圆角正方形)、细胞和EV层的两个主要成分(钻石)以及这些主要成分的加载蛋白质(圆圈;黄色代表细胞,粉色代表EV)(图6A)。根据它们在模型中的共享程度,进一步对蛋白质节点进行分类,网络从最共享到最特定进行组织排列(图7的第4到第1层)。在60多个细胞和EV来源的蛋白质中,至少与另一个条件共享(图7的第2到第4层),突出显示了独立于维度或磷酸盐类型的驱动CAVD模型中钙化的蛋白质。在这个综合分析中,仅有四种蛋白质被确认为细胞和EV蛋白质组之间的共享驱动因子,它们是维纳蛋白(VTN)、乳糖粘附蛋白(MFGE8)、聚类素(CLU)和钙蛋白L1H(S100A9)。在无偏子簇中,共享生物过程的蛋白质被分组(图7)。在三个条件之间共享的细胞和EV蛋白质中,突出的过程包括线粒体代谢(MAOB和MDH1)、细胞-基质粘附(THBS1、SOD3和NID2)以及肌动蛋白丝结合(VIM、MSN、CFL2、SYNE3、TPM4和TMSB4X)。仅有19%(215个中的41个,P < 0.05,根据精确二项检验)的蛋白质被确认为先前与瓣膜疾病有关(PheGenI,NCBI)。这个综合分析突显了体外钙化的已知和未知驱动因素。
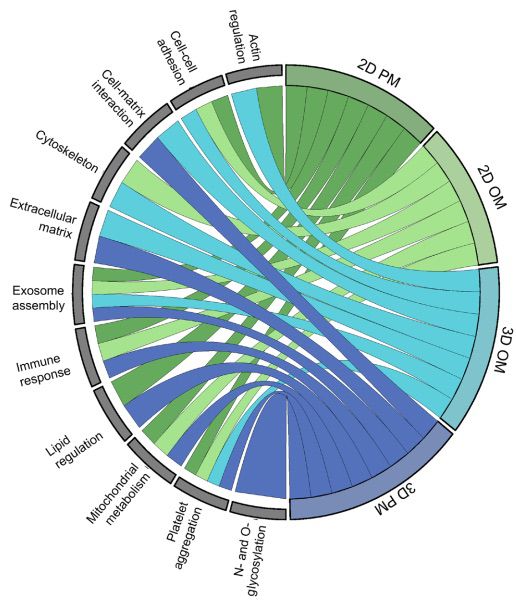
图7 将细胞和EV载体衍生的蛋白质组进行多组学整合,对钙化过程中已知和未知的蛋白质进行差异丰度排名
图8显示了每个体外模型中最好重现疾病的生物途径的图形摘要。本研究发现3D水凝胶模型能够重现人类CAVD组织的ECM蛋白质组、细胞-ECM相互作用和线粒体代谢调节的蛋白质谱。然而,无论是2D还是3D模型,在免疫/炎症反应方面都缺乏组织中发现的响应。虽然在瓣膜钙化的背景下,免疫共培养研究有限,但最近的单细胞研究表明细胞间的跨类型细胞间通信在钙化性瓣膜疾病中的重要性。本研究提出的模型为进一步增加复杂性提供了基础,例如共培养其他细胞类型、(病理)生理性周期性剪切/拉伸和额外的层特异性生物力学。虽然我们的研究主要关注纤维层和海绵层的特性,但富含弹性蛋白和受疾病保护的心室内膜在培养条件下已被证明在体内驱动独特的蛋白质特征,并且很可能主要对应于拉伸而不是压缩应力的瓣膜生理响应。
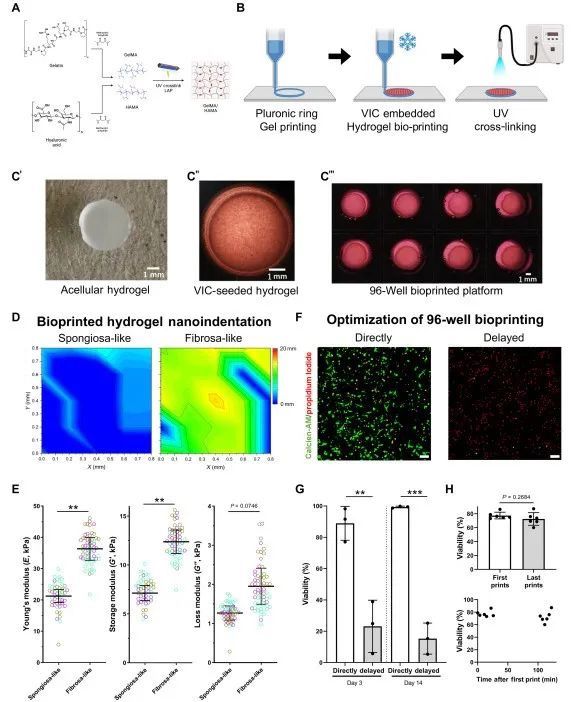
图8 总结每个模型在细胞和EV方面对CAVD组织重现的GO术语
2. 总结与展望
本研究注意到在NM条件下出现了轻度的自发性钙化,这可能是由于在生物打印过程中暴露于剪切应力和高达75 bar的压力,这两者都已被证明可以诱导肌成纤维细胞的活化。此外,本实验中使用的VICs来自患有疾病的人类瓣膜,可能包含了本研究团队之前证明的成骨肌成纤维细胞样细胞的一群细胞。尽管如此,与NM对照组相比,在3D培养中,在钙化培养基处理条件下,本研究在细胞和EV载体中发现了显著的蛋白质组学变化,证明了该模型的可行性。本研究利用基于自下而上的蛋白质组学鉴定的肽段的种属特异性,对细胞外基质(ECM)和其他潜在污染物进行了背景蛋白质组的整理。在未来的研究中,本研究将致力于使用针对ECM的蛋白质组学技术,来识别对胶原亚型、翻译后修饰和细胞-基质相互作用的机械响应。这些技术还可用于评估细胞和EV对水凝胶中使用的不同基质微环境的反应。这种EV分析还可以扩展到识别驱动EV与微囊泡分泌及其相应蛋白质组的因素。
文章来源:
https://www.science.org/doi/10.1126/sciadv.adj9793
(责任编辑:admin)
最新内容
热点内容


 Axial3D 与 GE HealthCare
Axial3D 与 GE HealthCare 3D打印鱼肉即将在新加坡及
3D打印鱼肉即将在新加坡及 美女在TikTok上展示自己购
美女在TikTok上展示自己购 Signify通过3D打印技术打
Signify通过3D打印技术打 组织损伤原位定制化修复的
组织损伤原位定制化修复的 3D打印使宜家家具个性化
3D打印使宜家家具个性化 3D打印实现外固定
3D打印实现外固定 哥伦比亚大学采用
哥伦比亚大学采用 失去1/3掌面,浙大
失去1/3掌面,浙大 3D打印软皮垫增强
3D打印软皮垫增强 3D打印替换患病脊
3D打印替换患病脊 功能材料新“大门
功能材料新“大门

