哈佛大学医学院《Science》子刊:利用3D打印治疗钙化主动脉瓣病
时间:2024-03-13 11:41 来源:EngineeringForLife 作者:admin 阅读:次
来自美国哈佛大学医学院的Elena Aikawa团队建立了一种基于生物材料的CAVD模型,模拟了人类易患纤维层的生物力学特性,并将其3D生物打印到96孔板中。通过液相色谱串联质谱分析细胞蛋白质组和囊泡组,比较了3D生物打印模型与传统的2D单细胞培养模型与人类CAVD组织之间的差异。3D生物打印模型高度重现了CAVD细胞蛋白质组(与2D蛋白质的70%相比,达到94%)。将细胞和囊泡数据集整合起来,识别出与AV钙化普遍相关的已知和未知蛋白质。本研究探讨了2D和3D生物工程系统如何重现人类疾病的独特方面,将多组学作为一种评估高通量生物工程模型系统的技术,并为未来的药物发现提供了潜力。相关工作以题为“Intracellular proteomics and extracellular vesiculomics as a metric of disease recapitulation in 3D-bioprinted aortic valve arrays”的文章发表在2024年2月28日的国际顶级期刊《Science Advances》。

1. 创新型研究内容
本研究利用细胞和EV蛋白质组学,通过评估作为静态生物力学特性的函数发生的细胞和EV蛋白质组水平的变化,全面而整体地表征体外模型对该疾病的重现。此外,本研究还开发、验证并对CAVD发病机制的3D生物工程模型系统进行基准测试,这些模型系统与高通量药物筛选平台兼容。
【高通量生物打印平台创建了一系列具有生物力学相关性的CAVD模型数组】
本研究采用甲基丙烯酰化明胶和透明质酸(GelMA/HAMA)构建了一个水凝胶系统,其中携带有初代人类VICs,并根据AV特定的(和疾病驱动的)生物力学进行调节(图1A和B)。使用的VICs来自人类CAVD组织样本。生物打印参数经过优化,以适应适用于高通量筛选的96孔板阵列,显示出孔井之间的一致性(图1B和C)。VICs对ECM的硬度有感知和响应能力;因此,对于成功的CAVD模型来说,材料硬度的重现必不可少,与原生主动脉瓣层次相一致。通过调节紫外(UV)固化时间,操控了水凝胶的机械特性,并在96孔板阵列格式中复制了海绵质(受疾病保护)和纤维质(易患疾病)瓣膜层的力学特性,基于先前的研究并通过纳米压痕分析进行了确认(图1D和E)。纳米压痕测量的热图显示了水凝胶表面上的空间分辨率一致性的生物力学测量结果(图1D),并通过定量分析重现了已知的层特异性生物力学特性(图1E)。由于钙化主要发生在主动脉瓣的纤维质层,因此后续的实验中使用了类纤维层的水凝胶模型。
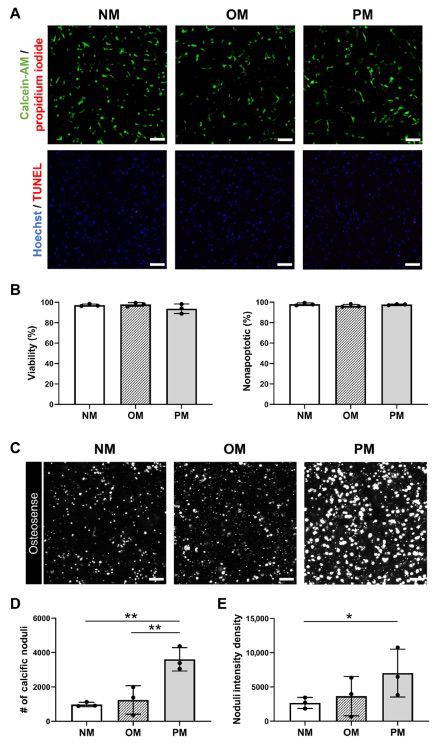
图1 主动脉瓣模型的3D生物打印
通过展示在96孔板生物打印水凝胶阵列中广泛调节生物力学特性的能力,使其覆盖一系列(病理)生物学相关的硬度范围,随后的实验专注于与疾病相关的类纤维层水凝胶,重现了易患疾病的主动脉瓣区域的生物力学特性。先前的研究已经显示,培养14天后,VIC封装的水凝胶模型在不同培养条件下的钙化情况存在显著差异,借此指导了本研究的培养时间表。在正常培养基(NM)或两种刺激钙化的培养基:有机磷酸盐成骨培养基(OM)或无机磷酸盐促钙化培养基(PM)中培养14天后,类纤维层水凝胶中的VIC在所有培养基类型和重复实验中维持了较高的存活率(图2A,顶部和B,左侧)。瓣膜钙化可以是不同过程的产物,例如类骨母细胞样VIC的活性矿物沉积,或与细胞凋亡相关的钙化,后者通常被认为是体外培养的人工过程。末端脱氧核苷酸转移酶介导的脱氧尿苷三磷酸核苷酸末端标记(TUNEL)染色显示,在所有水凝胶和培养条件中,几乎没有与细胞凋亡相关的细胞死亡,证实钙化很可能不是由细胞死亡相关的钙积累介导的(图2A,底部和B,右侧)。通过使用近红外钙示踪剂(Osteosense680)对类纤维层96孔水凝胶阵列中的钙化进行了评估。所有的3D阵列培养基条件都显示了一定程度的Osteosense680阳性染色(图2C)。然而,在OM和PM条件下,微小钙化灶数量(图2D)和信号强度(图2E)均呈上升趋势,并且在统计上存在显著增加。
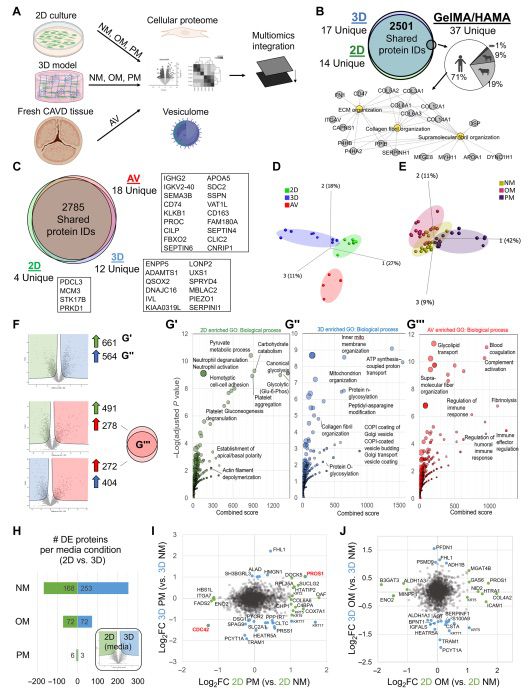
图2 在有机磷酸盐和无机磷酸盐培养基条件下,培养在类纤维层水凝胶中的VICs保持存活,并诱导钙化
【细胞蛋白质组学鉴定了在3D生物打印阵列中建模的独特病理过程】
一旦细胞存活和钙化诱导得到确认,本研究使用基于质谱的蛋白质组学方法评估了3D生物打印的VIC水凝胶CAVD阵列条件下与传统的2D VIC单细胞培养条件下分别对原生CAVD组织表型的重现能力(CAVD)(图3A)。在3D和2D条件下,鉴定出了超过2500种蛋白质,两种体外模型之间的鉴定蛋白质的重叠率超过99%(图3B)。为了去除培养准备过程中可能产生的潜在背景污染物,本研究还探究了仅含细胞外水凝胶的蛋白质组,并对其与Hathewaya histolytica(胶原酶来源)、猪(GelMA/HAMA来源)、牛(培养血清来源)和人类(用于识别目标蛋白质组同源性)蛋白质组进行了比对(图3B)。随后的分析中包括了CAVD组织来源的细胞(图3C)。未经过滤的主成分分析(PCA)显示了按模型类型(图2D)和钙化培养基处理(图3E,仅体外)进行的三种蛋白质组的无偏聚类。在2D和3D体外模型之间,测得的蛋白质组中有48%的差异丰度,而CAVD与2D或3D之间的差异丰度不到30%。这表明体外模型的细胞蛋白质组之间的差异比它们与新鲜组织的细胞蛋白质组之间的差异更大(图3F)。接下来,本研究确定了表征2D和3D条件之间以及体外模型与组织之间关键差异的基因本体论(GO)术语(图3,G'和G"),2D培养中的蛋白质与血小板聚集、同型细胞间粘附、典型糖酵解和肌动蛋白丝解聚相关,而3D培养中的蛋白质与胶原纤维排列、蛋白质N-和O-糖基化、COPI包被小泡运输以及线粒体组织相关。最后,分离的CAVD细胞中富集了与调节免疫反应、补体激活和糖脂转运相关的蛋白质(图3G),与原生CAVD中存在的免疫细胞浸润一致。
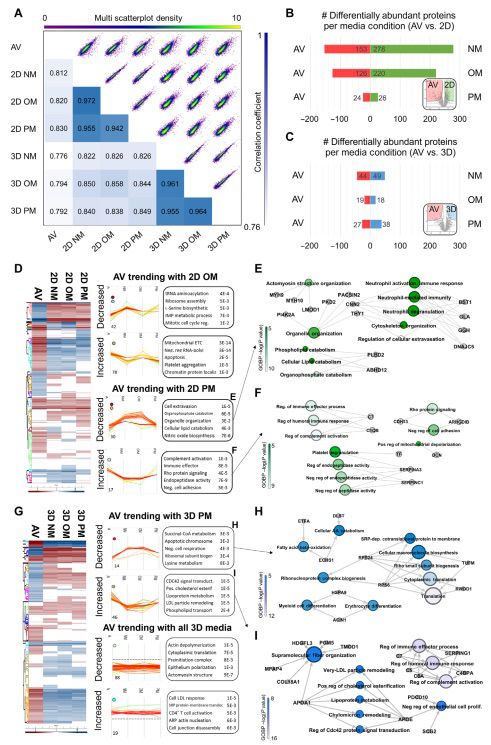
图3 CAVD水凝胶模型的细胞蛋白质组学揭示了模拟病理过程的转化靶点
本研究的目标是将体外培养的细胞蛋白质丰度与CAVD来源的细胞蛋白质丰度进行相关性分析。成对相关性分析显示,所有体外培养基条件之间相关性都很高(r > 0.9)。全面的蛋白质组相关性分析显示,2D和3D细胞与CAVD细胞之间存在显著相关性(2D ravg = 0.82;3D ravg = 0.79)。接下来,将2D和3D蛋白质丰度与所有培养基条件下的AV数据集进行比较(图4B和C)。在2D模型中,与原生CAVD相比,NM是具有最多的差异蛋白质,而PM是具有最少的差异蛋白质(图4B);与之不同的是,3D阵列中的细胞蛋白质中很少有与CAVD有差异丰度的蛋白质(图4C)。总体而言,3D模型在94%的测量蛋白质中重现了CAVD细胞蛋白质丰度的特征,而2D模型则重现了70%的蛋白质丰度。这表明3D模型可能在整体上最适合识别在疾病诱导过程中蛋白质丰度变化,这种变化最接近于在原生组织中观察到的变化。
接下来,本研究使用蛋白质趋势分析来确定在2D和3D条件下,哪些关键蛋白质最能重现CAVD细胞蛋白质组(图4D至H)。在2D PM条件下,重现CAVD丰度的蛋白质与细胞粘附(CDH13和ARHGDIB)和细胞骨架组织(PACSIN2、CNN2和THY1)相关(图4D至F)。在3D条件下,OM和PM培养基都重现了与超分子纤维组织(MFAP4、COL18A1和TMOD1)、脂蛋白代谢(APOA1和APOE)、负调节内皮细胞增殖(SCG2、PDCD10)和脂肪酸β-氧化(ATFA和ECHS1)相关的CAVD蛋白质丰度(图4G至I)。本研究还发现了一组在所有3D培养基条件下与CAVD组织趋势一致的蛋白质(图4G,底部)。这种以细胞蛋白质组为中心的分析无偏地显示,3D水凝胶阵列重现了在2D单细胞培养中无法捕捉到的疾病的独特方面。
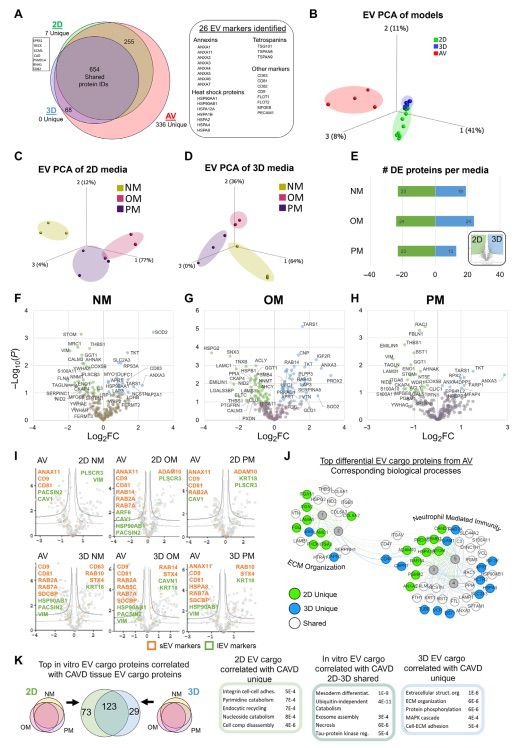
图4 3D生物打印模型的细胞蛋白质组能够最好地重现在钙化条件下的CAVD细胞病理学
(责任编辑:admin)
最新内容
热点内容


 Axial3D 与 GE HealthCare
Axial3D 与 GE HealthCare 3D打印鱼肉即将在新加坡及
3D打印鱼肉即将在新加坡及 美女在TikTok上展示自己购
美女在TikTok上展示自己购 Signify通过3D打印技术打
Signify通过3D打印技术打 组织损伤原位定制化修复的
组织损伤原位定制化修复的 3D打印使宜家家具个性化
3D打印使宜家家具个性化 3D打印实现外固定
3D打印实现外固定 哥伦比亚大学采用
哥伦比亚大学采用 失去1/3掌面,浙大
失去1/3掌面,浙大 3D打印软皮垫增强
3D打印软皮垫增强 3D打印替换患病脊
3D打印替换患病脊 功能材料新“大门
功能材料新“大门

