基于水凝胶的3D打印微米级生物力学传感器
时间:2024-07-21 08:14 来源:3D打印微米级生物力学传感器 作者:admin 阅读:次
来自意大利帕多瓦大学的Nicola Elvassore 团队与来自英国伦敦大学学院(UCL)儿童健康研究所的Gabriel L. Galea团队合作开发了一种具有微米级分辨率的弹性弹簧状力传感器,通过活体内3D生物打印直接在生长中的鸡胚闭合神经管中制造。将校准后的传感器读数与计算力学建模相结合,可以直接量化胚胎组织所施加的力和完成的工作。随着它们向胚胎中线移动,闭合神经管的两半在神经褶皱贴合期间达到了超过一百纳牛顿的压缩力。通过药理学抑制Rho相关激酶以减少促闭合力,显示出存在主动的抗闭合力,这些力逐渐加宽神经管,必须克服这些力才能实现神经管的闭合。总的来说,本文的方法发现强调了机械力和组织形态发生之间错综复杂的相互作用。相关工作以题为“Quantifying mechanical forces during vertebrate morphogenesis”的文章发表在2024年07月05日的国际顶级期刊《Nature Materials》。

1.创新型研究内容
本文提出了一种适用于脊椎动物形态力的量化方法,通过在活体鸡胚内创建类似弹簧的纳牛顿力传感器,采用活体内3D(i3D)生物打印方法。这种i3D生物打印之前已经被用于在小鼠皮肤的表皮、大脑的硬脑膜和骨骼肌的肌腱下打印毫米级结构。本文重新开发了这项技术,以实现生物相容的光敏聚合物在3D弹性水凝胶中的微米级光交联。结合活体成像显微镜技术,i3D生物打印的类似弹簧的力传感器允许动态量化神经胚形成力学。作为原理证明,本文展示了在Rho相关蛋白激酶(ROCK)抑制的胚胎中可量化的闭合力学的破坏。
【在胚胎中适应性生物打印弹性形状】
本文提出了一种策略,可直接在活体胚胎中生成弹性组织以适应组织几何结构,并且无需专业设备,仅需现成的双光子显微镜(图1a)。双光子i3D生物打印能够在共聚焦成像的鸡胚中直接创建具有高位置和结构准确性的3D形状(图1a,b)。优化的实验条件可以在解剖学上定义的兴趣区域(闭合的神经管中)可重复地产生预先设计的结构(图1b)。本文利用星形图案展示了打印尺寸的多样性,其中跨越了两个数量级,从~1µm到200µm(图1b)。
神经管的闭合需要神经褶的内侧贴合,从而在物理上缩小开放区域,并允许背侧中线融合通过“拉链点”进展(图1c)。神经管拉链速度并未受到i3D打印的显著影响。随着拉链前进和胚胎继续发育,刚性的i3D打印结构可以被移位并从闭合管中排出(图1d)。它们的位移表明胚胎产生了机械力。为量化这些力,本文改良了i3D生物打印技术,创建了弹性的、顺从的形状,锚定在闭合的神经褶上,这样它们的变形就可以作为神经褶内侧贴合产生的力的读数(图1c)。本文将这些结构称为活体内力学感受水凝胶(iMeSHs)。
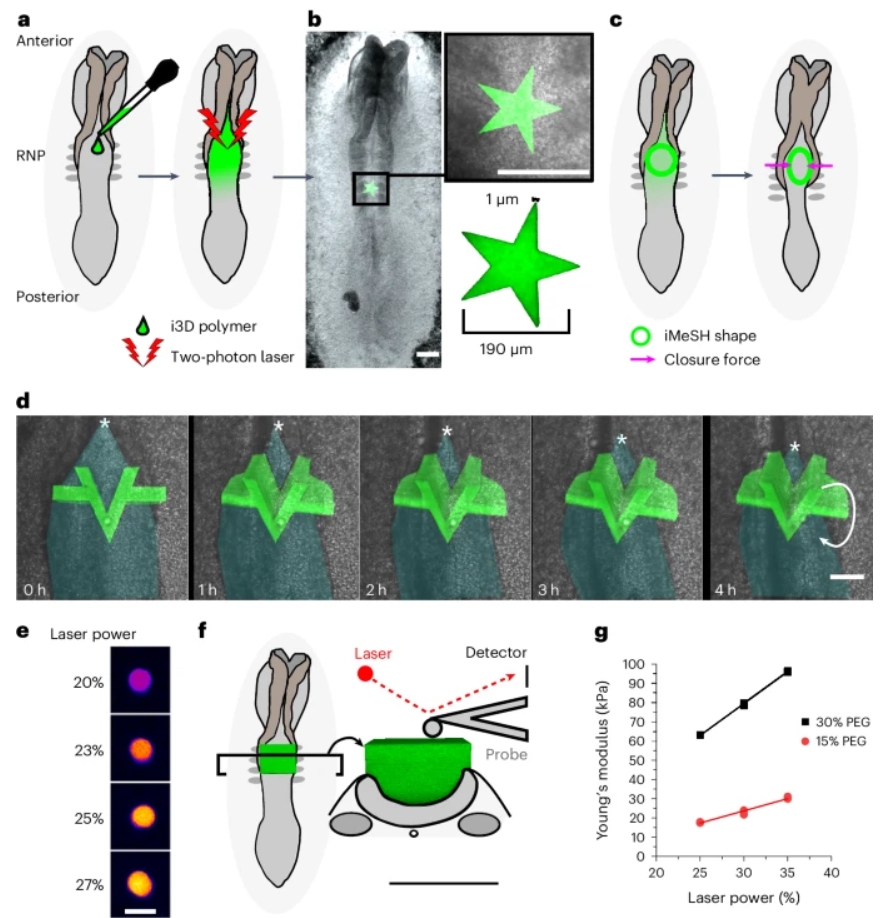
图1 i3D生物打印技术具有精确确定的位置、几何形状和刚度。
【从iMeSH变形推断形态发生力学】
整合到神经上皮中的iMeSH结构在闭合腔内受到中外侧压缩(图2)。本文测试了各种潜在的iMeSH几何形状,以通过形状变形来量化力。首先,使用具有定义的杨氏模量的玻璃基底上的桥梁形状的定制有限元方法(FEM)模型,显示可以预测特定形状的力-变形响应。可以在神经褶之间将简单的iMeSH条打印到不同的深度,并且可以在一个胚胎内打印多个形状。当神经褶合拢时,这些形状可以变形,产生非常均匀的曲率,证明了iMeSH材料的同质性(图2a)。两个特性使得这种形状不适合用于力的量化。iMeSH和神经褶之间的接触面非常狭窄,产生的应力峰值通常导致条状物从组织上脱离。此外,形状的应力-应变关系完全是非线性的,以至于由其施加的力导致的变形完全取决于其初始曲率或力的应用方向。本文开发了第二种形状以提高变形和力应用的可预测性:沿着神经褶的硬杆通过两个V形弹簧相互连接(图2b)。这种形状可以在体内重现性地打印,并在受压时产生V形弹簧的内侧变窄(图2b)。对单个形状的定制FEM建模显示,神经褶产生了低至数百纳牛顿的力。然而,这种形状的变形-力关系在生物学相关的变形幅度上是高度非线性的。在小变形下,个性化FEM模型显示,神经管需要77.9±39.1纳牛顿(平均值±标准偏差,n=4;组织接触表面长170µm)来压缩iMeSH的V形10%的初始宽度(8µm)。
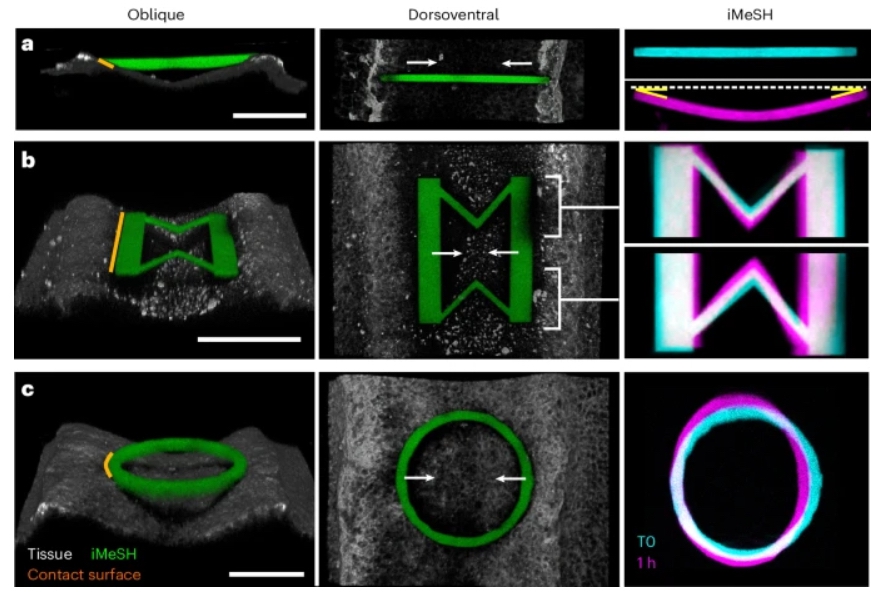
图2 优化力传感器的形状以量化形态发生力
相比之下,简单的圆柱形状在相关变形范围内提供了准线性的变形-力关系(图2c)。整合到神经褶之间的圆柱形状阻止了相邻神经管的闭合,形成了一个局部开放的缺陷(图3a,b)。在长时间尺度上,侧翼拉链点的融合进展包围着打印物体,从经验上将局部中外侧贴合与吻尾向拉链分离。具有过度结构刚度的圆柱也阻止了拉链前进接触iMeSH时的神经褶贴合,但没有显示出可以从中量化力的变形。因此,必须调整iMeSH力传感器的结构以匹配组织力产生特性。
根据特定结构的FEM模型进行的力量化,可以通过理想化的圆柱形状来近似。使用FEM,本文推导了一个参数化方程,通过该方程,iMeSH圆柱的变形可以作为施加力的通用读数(图3c-e)。模拟的圆柱狭窄和对侧弹性扩张与由侧面接触施加的机械力呈准线性相关(图3e)。这种线性关系在高达约20%的应变(定义为圆柱宽度的百分比变化)时是可靠的,尽管可以使用特定形状的FEM来量化更大变形的力。在生物信息学中预测的iMeSH圆柱的中压缩和垂直伸长在体内被观察到(图3f)。
在发育的晚期时间点,即菱脑颈神经孔闭合完成后,神经管继续压缩iMeSH力传感器。圆柱的中外侧狭窄相对于其原始宽度允许计算力(图3g)。鉴于高变形幅度和围绕圆柱圆周的接触点的演变,晚期时间点获得的力值不应被视为绝对值。然而,聚合物材料属性随时间非常稳定:打印后具有80.56±0.14 kPa的AFM计算硬度的iMeSH在15天后保持了80.58±0.35 kPa的硬度。圆柱形状的FEM模型显示,8µm的中压需要神经管施加54.98±11.20纳牛顿(平均值±标准偏差,n=4;组织接触表面,~75µm长)。因此,两种建模形状之间每单位长度施加的力的量化是一致的。施加到iMeSH圆柱上的力以低能量的弹性能量形式存储(图3h)。经过转换,发现1 pJ可以存储在大约1×107个ATP分子中,尽管化学能到机械能的生物转换可能非常低效。
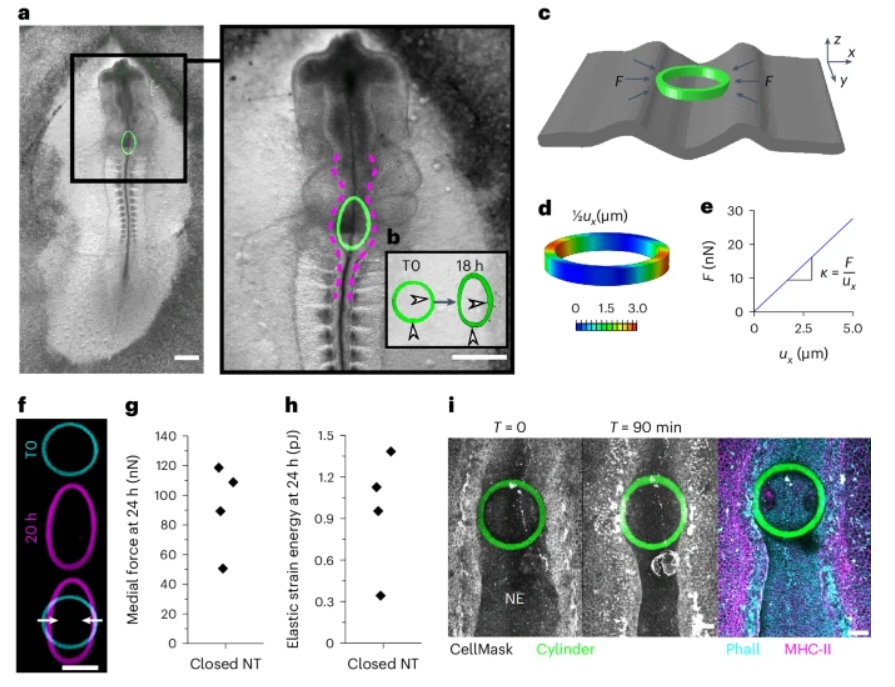
图3 对闭合神经管施加的内侧力进行量化
【神经胚形成中的闭合前力与抗闭合力平衡】
iMeSH力传感器生物打印与时间延迟成像的结合,使得在体内动态描绘形态发生力成为可能(图4a,b)。为了量化力,本文将iMeSH圆柱附着在神经褶之间悬挂。在胚胎的神经褶间有iMeSH圆柱的情况下,神经上皮细胞保持了相对于周围组织的预期F-actin富集(图3i)。沿着iMeSH形状没有观察到异常压缩、肌动蛋白肌球蛋白的破坏或组织的积累。本文预计,压缩水凝胶的细胞会暴露于与它们通常经历的不同硬度和机械力中。细胞的机械变形预计会改变张力或压力,众所周知,这会触发包括压电通道开放和YAP核定位在内的信号级联反应。例如,本研究团队的近期研究表明:小鼠胚胎表面外胚层的YAP核水平与局部细胞边界张力有关。与比细胞遇到的自然环境更硬的水凝胶材料接触所触发的局部机械传导事件,可能会导致不同的细胞反应。例如,在对医疗植入物的异物反应背景下已经显示了这一点。机械传导可能导致转录变化、炎症介质的释放或其他组织变化。然而,这些不太可能改变本文对所描述的方法的解释,因为这些变化所需的时间尺度与报告的力量测量的时间尺度不同。
顶端神经上皮背侧弯曲,而悬挂在神经褶之间的iMeSH结构仅在局部抵抗这种变形。神经褶的中线贴合对iMeSH边缘施加增量压缩力,导致其向中线位移(图4a)。随着胚胎施加压缩力,iMeSH圆柱的应变(定义为宽度的百分比变化)逐渐增加,在一至两小时的发育相关窗口内达到约100纳牛顿,然后趋于平稳或开始下降(图4b-e)。
药理学上抑制肌球蛋白激活激酶ROCK被认为可以阻止鸡和哺乳动物胚胎中的神经褶升高。本文观察到F-actin的丢失,如之前所报道,以及在ROCK抑制的胚胎中神经褶逐渐变宽(图4c)。这呈现出额外的力量化挑战:像悬臂梁这样的力传感器简单地放置在神经褶之间,仅当周围组织压缩它们时才会变形。将iMeSH圆柱直接锚定到胚胎组织上解决了这个问题,允许它们通过组织扩张来拉伸(图4c-e)。ROCK抑制的胚胎每单位时间产生的力比载体对照组少:它们在60分钟内的最大冲量显著更低。尽管如此,值得注意的是,ROCK抑制的胚胎施加的绝对抗闭合能量与对照组的促闭合相当(图4f)。潜在的力生成机制,没有被Rho/ROCK激活的阻断所打断,包括持续的细胞增殖、流体静力的细胞外基质扩张和细胞迁移。
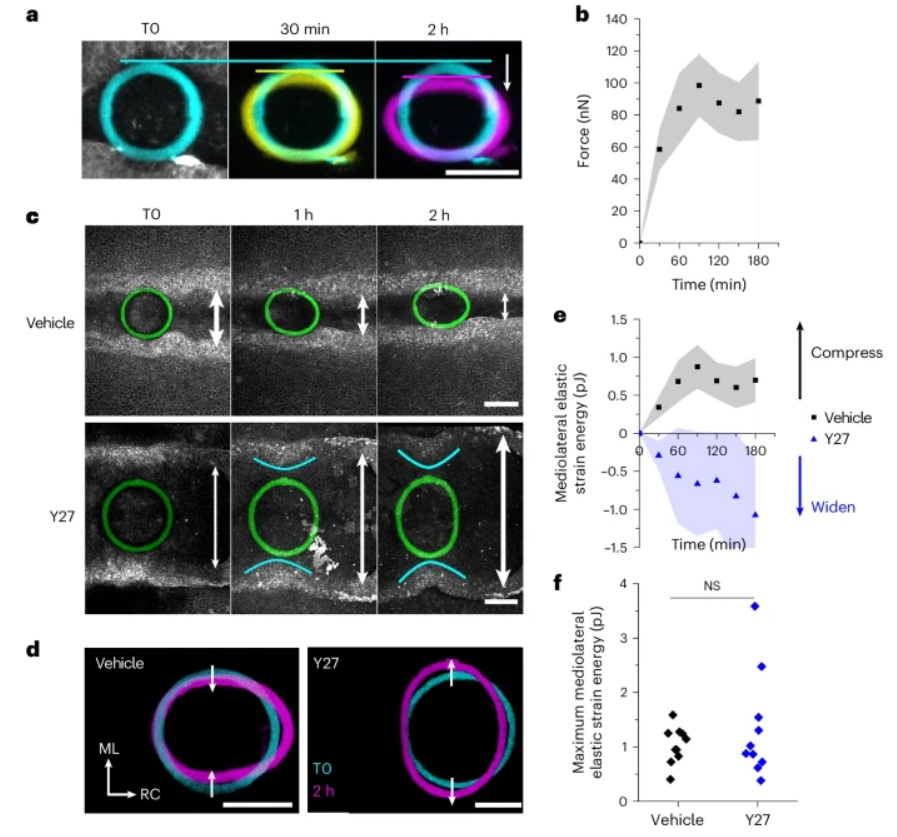
图4 在神经胚形成过程中对形态发生力学进行动态量化
2.总结与展望
以高空间分辨率和位置精度打印的iMeSH力传感器,结合时间延迟实时成像,使得能够量化在脊椎动物神经管闭合过程中产生的机械能。iMeSH能够量化胚胎组织产生的纳米牛顿级别的力,无需专业设备,仅需现成的双光子显微镜和液体聚合物。这项技术具有高度的通用性,轻松适应初始形态和力产生方向的差异,允许动态描绘压缩力和拉伸力。通过光打印一个简单的圆柱形状,可以使用一个通用方程从变形中计算力。其他方法可以用来量化皮科牛顿级别的力、压力、分子应变或偏转,但iMeSH在以高分辨率量化在不可预测的方向上应用的力方面是独一无二的,具有可变组织几何结构的能力。
文章来源:
https://www.nature.com/articles/s41563-024-01942-9
(责任编辑:admin)
最新内容
热点内容


 双组份快速固化硅胶油墨为
双组份快速固化硅胶油墨为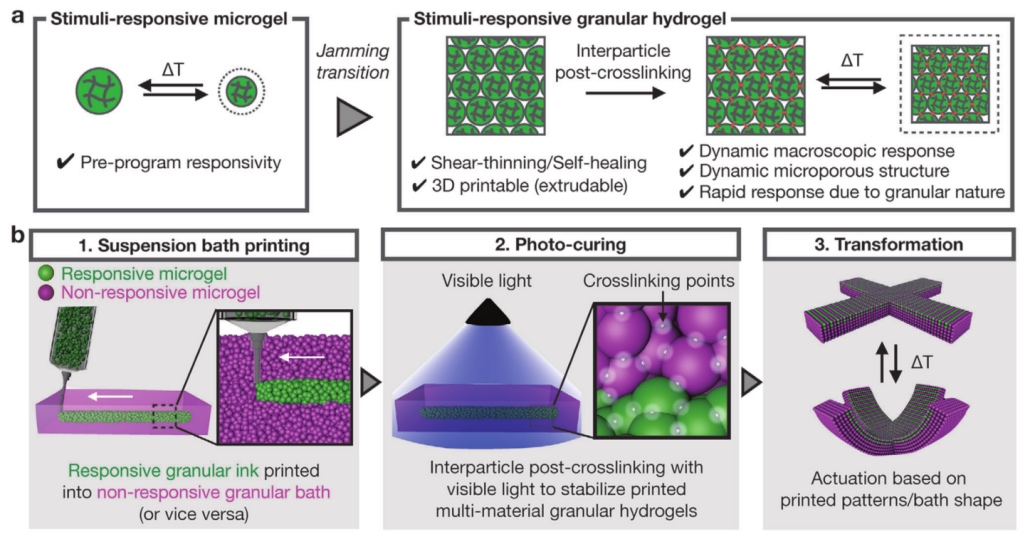 《AM》:4D打印温度响应颗
《AM》:4D打印温度响应颗 华中科大柳林团队:基于原
华中科大柳林团队:基于原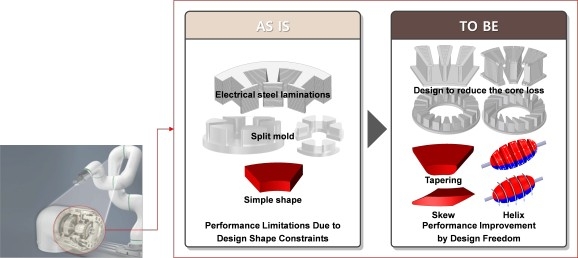 韩国研究人员采用磁性3D打
韩国研究人员采用磁性3D打 HHS启动临床试验:利用3D
HHS启动临床试验:利用3D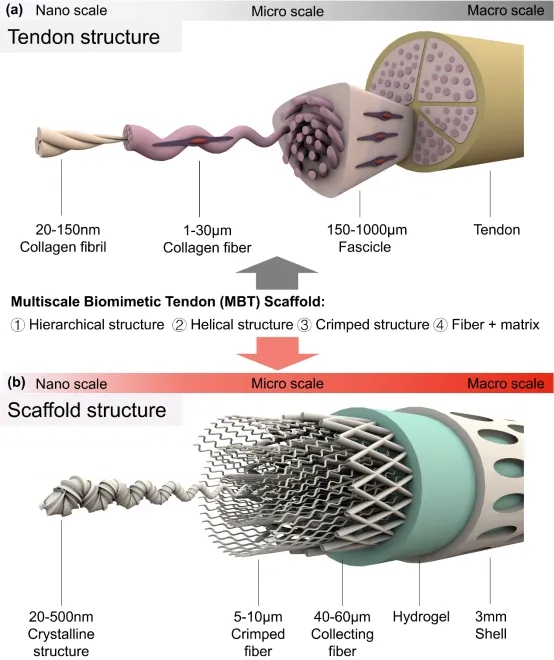 《AFM》:3D打印多尺度仿
《AFM》:3D打印多尺度仿 《Small Science
《Small Science 南洋理工-剑桥大
南洋理工-剑桥大 清华大学:抗拉强
清华大学:抗拉强 《Science》:一
《Science》:一 国产大尺寸陶瓷3D
国产大尺寸陶瓷3D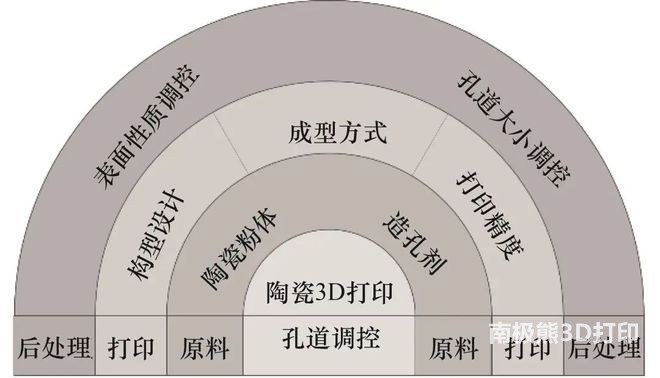 南京工业大学:基
南京工业大学:基

