基于人诱导多能干细胞来源心肌细胞的功能性心肌组织直接3D打印构建(2)
时间:2023-11-02 09:33 来源:生物打印与再生工程 作者:admin 阅读:次
三、环形功能性心脏组织的可重复和准确的3D生物打印
为了生产有层次结构的组织或器官,控制细胞分布是很重要的。因此,在印刷前需要将细胞掺入油墨中。为了评估细胞的添加是否会影响墨水的可打印性,该团队将25 Mio/ml hiPSC-CMs加入到CollHA3-3墨水中,用以打印环状组织。所得到的环是稳定的,并表现出良好的均匀性 (图3a)。
在组织构建后(第0天)和制造后7天(第7天)使用钙黄素- am /乙锭同二聚体-1(EthD-1)对打印的组织和通过滴铸生产的组织进行染色。在任何时间点,铸型组织和打印组织的活力均无显著差异。在第30天通过免疫荧光染色观察hiPSC-CMs的切片和整个组织的形态和分布。打印的hiPSC-CMs显示出典型的肌合成α-肌动蛋白条纹,以及缓慢的骨骼肌钙蛋白- i (ssTnI)和心脏肌钙蛋白- i (cTnI)(图3b)。打印组织中α-肌动蛋白的表达均匀分布(图3c)。同时,ssTnI的表达水平向组织边缘升高,证明了打印的hiPSC-CMs的行为与分化和铸造的hiPSC-CMs相似,表明了打印的hiPSC-CMs生成了有组织的肌瘤,并且具有相互连接的不同成熟状态的hiPSC-CMs。
45个打印组织中在第3天已经表现出了自发的同心收缩(图3D)。通过Fluo-4荧光强度的增强和减弱反映了打印组织在收缩周期中表现出钙的同步流入和流出 (图3f)。测量不同区域的荧光强度可以识别出起搏中心(ROI3,图3g),其行为随着时间的推移显示出高同步性,远处区域达到荧光强度峰值的延迟约为100 ms(1帧)(图3g)。这进一步证明了hiPSC-CMs在打印组织内形成了相互连接的网络。
为了适用于作为模型系统或移植,工程心脏组织必须对药物刺激表现出生理反应。因此,对打印组织首先用肾上腺素能激动剂苯肾上腺素(PE)处理,然后用维拉帕米(Ver)处理(一种l型钙通道抑制剂)。PE刺激导致收缩频率翻倍,但收缩程度并无显著变化(图3i,j)。随后加入维拉帕米,收缩停止(图3i,j)。
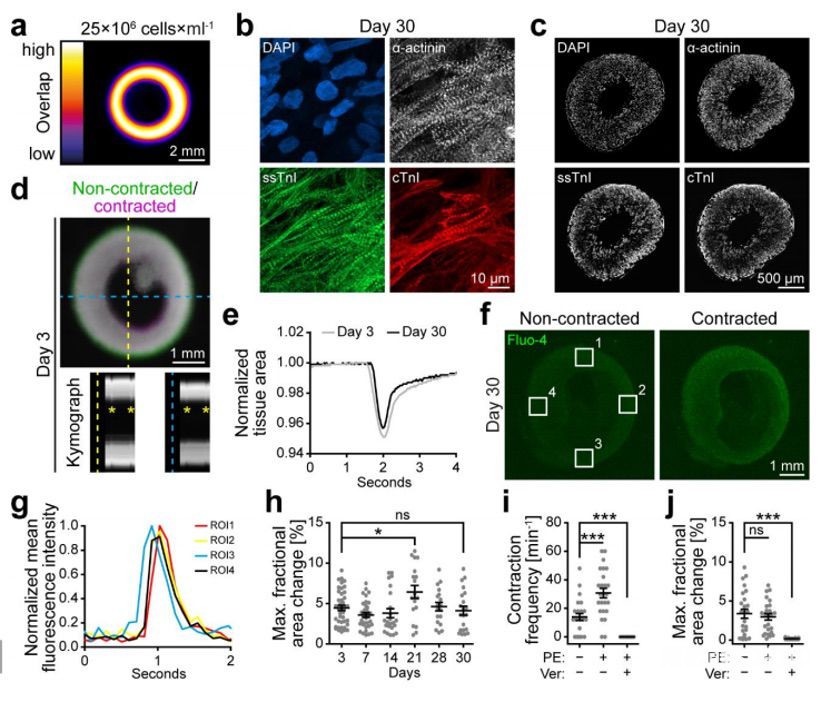
图3 打印hiPSC衍生的心肌细胞形成功能性心脏组织
四、打印的心脏组织对被动阻力施加同心力
为了检验打印的环是否可以施加类似于心脏的同心圆力,该团队设计并制造了由六个柔性柱组成的阵列(图4a)。将打印的环转移到柱阵列上,并在柱子周围压实,培养至第30天(图4b)。在收缩周期中,打印的环能够同步使6根柱子发生偏转,说明它们能够对阻力施加同心圆力。
与自由漂浮的环一样,这些环在第3天出现了自发收缩。到第28天,收缩频率在每分钟20次左右保持稳定,第30天略有下降(图4c)。在第30天进行PE和Ver处理。PE刺激显著增加了被动机械刺激环的收缩频率 (图4f)。根据柱挠度计算打印组织的产生的力,PE刺激后产生的力增加(图4g)。Ver处理显著降低了收缩频率和产生的力,24个环中有22个停止了跳动(图4f、g)。这里打印的环所产生的力与仅由人类多能干细胞衍生的心肌细胞产生的力相似。
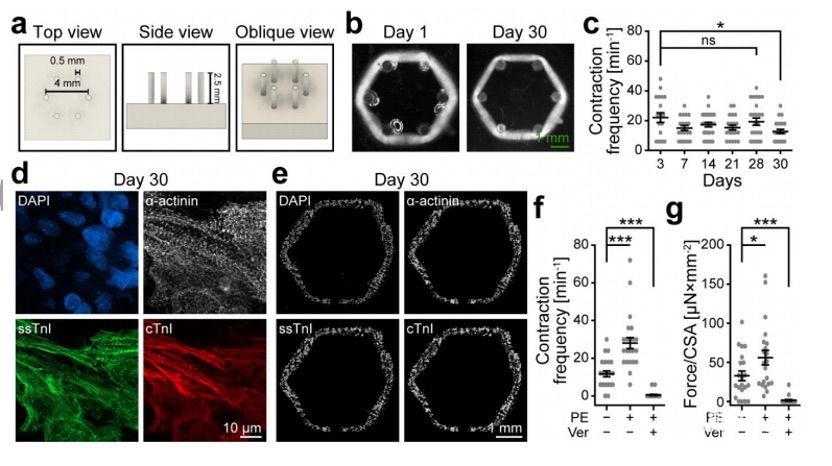
图4 打印的心脏组织对被动阻力施加同心力
五、胶原蛋白/透明质酸墨水3D生物打印人类心脏心室功能模型
为了测试该方法是否能够实现人类心脏心室功能模型的3D生物打印,团队设计并打印了一个高度为14毫米,最宽处直径为8毫米的模型(图5a)。
心室在制造后7天达到稳定,并发生自发的同步收缩,在培养过程中持续长达100天(图5b,c)。此外,PE刺激可使培养30 天的打印心室模型收缩频率加快 (图5d)。对染色心室的分析显示,hiPSC-CMs在第100天显现出典型的α-肌动蛋白和cTnI的条纹(图5e)。hiPSC-CMs分布在整个打印组织中,α-肌动蛋白和cTnI表现出相似的表达模式(图5f)。实验表明:该组织至少可以培养100天。
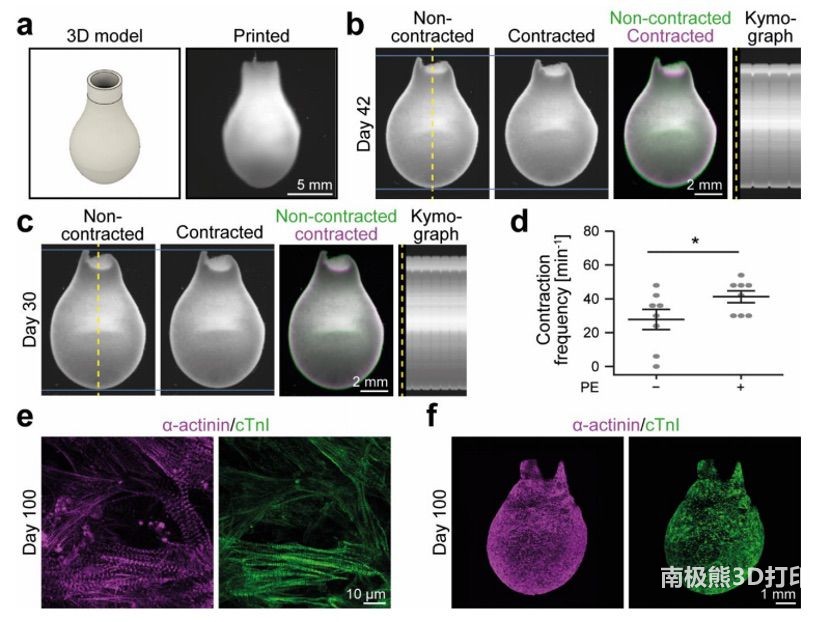
图5 凝胶方法使功能心室模型的3D生物打印成为可能
总结
本文展示了直接打印嵌入胶原基生物墨水的hiPSC-CMs生成功能性心脏组织的方法。以下结果可有力支持这一结论:hiPSC-CMs可以精确且可重复地3D生物打印成多种形状的心脏组织,并形成相互连接的、自发和同步收缩网络,并且可以通过药物刺激来调节频率;打印组织能够对抗被动阻力发生收缩。这里开发的方法为生成复杂的功能性心脏组织开辟了新的可能性:直接打印hiPSC-CMs以及打印其他细胞类型的方法,可用于打印健康和患病的心脏模型。此外,精确放置不同心肌细胞亚型的能力,加上在生物墨水中添加导电材料的技术,在未来可以进一步模拟整个组织中的动作电位传播,以更准确地复制心脏电生理。
参考文献
Tilman U. Esser, Annalise Anspach, Katrin A. Muenzebrock, Delf Kah, Stefan Schrüfer, Joachim Schenk, Katrin G. Heinze, Dirk W. Schubert, Ben Fabry, Felix B. Engel*(2023). Direct 3D-bioprinting of hiPSC-derived cardiomyocytes to generate functional cardiac tissues
https://doi.org/10.1002/adma.202305911
(责任编辑:admin)
最新内容
热点内容


 双组份快速固化硅胶油墨为
双组份快速固化硅胶油墨为 《AM》:4D打印温度响应颗
《AM》:4D打印温度响应颗 华中科大柳林团队:基于原
华中科大柳林团队:基于原 韩国研究人员采用磁性3D打
韩国研究人员采用磁性3D打 HHS启动临床试验:利用3D
HHS启动临床试验:利用3D 《AFM》:3D打印多尺度仿
《AFM》:3D打印多尺度仿 《Small Science
《Small Science 南洋理工-剑桥大
南洋理工-剑桥大 清华大学:抗拉强
清华大学:抗拉强 《Science》:一
《Science》:一 国产大尺寸陶瓷3D
国产大尺寸陶瓷3D 南京工业大学:基
南京工业大学:基

