浙江大学贺永团队:同轴生物3D打印构建可灌注血管芯片
时间:2022-10-08 10:22 来源:EngineeringForLife 作者:admin 阅读:次
血管芯片这一概念正日益受到重视,因其可用于研究微尺度流体动力学、组织级别的生物分子传递以及良好三维细胞外基质微环境下的细胞间通信。然而目前少有血管芯片能做到长期稳定灌流,并着眼于血管新生过程。由于血管新生是肿瘤发展的必要条件,抗血管新生药物一直在癌症治疗中发挥着重要作用。我们以同轴生物打印为工具,构建了一种新颖、可靠的抗血管新生药物筛选血管芯片,该芯片高度模块化集成,能用于灌流培养和实时观测。为了在保证良好生物活性的前提下维持载细胞管的液体灌通,受到心脏支架的启发,在水凝胶管内引入了聚己内酯(PCL)支架用于支撑管腔。结合细胞培养监控系统,系统可实现血管新生过程的实时观测。这项工作开发了一种用于抗血管新生筛药的灌流系统,不仅可以进行药物评估,而且在组织工程、药代动力学和再生医学领域的其他血管模拟场景中也有潜在的用处。
相关研究“Perfusable Vessel-on-a-Chip for Antiangiogenic Drug Screening with Coaxial Bioprinting”近期发表在International Journal of Bioprinting杂志上,浙大机械学院顾则明博士为第一作者,浙大机械学院贺永教授和谢超淇博士后为共同通讯作者。
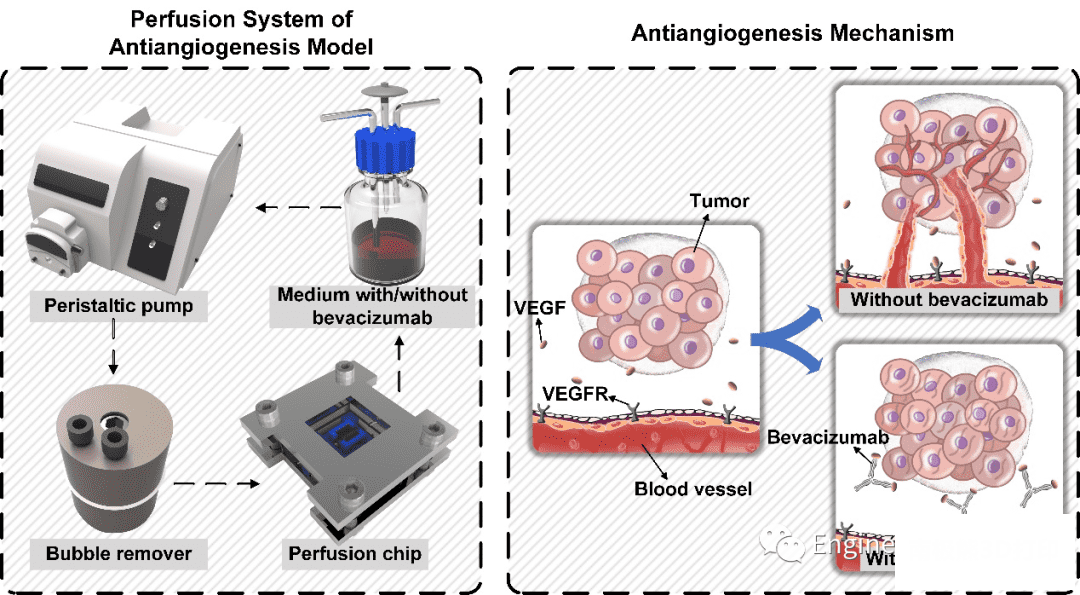
血管芯片的构建流程如下:1. 同轴生物打印载内皮细胞的水凝胶管;2. 将载细胞管切成小段并在培养箱中培养5-7天,待内皮细胞伸展、增殖形成内皮化类血管;3. 旋转打印PCL支架;4. 将PCL支架脱模并灭菌;5. 将PCL支架插入内皮化类血管结构中;6. 用含VEGF的GelMA生物墨水包裹类血管结构在预先准备的聚乳酸(PLA)框架中浇筑成水凝胶块;7. 将水凝胶块放入芯片中,连接上进出口,用螺栓紧固后即可进行灌流培养。
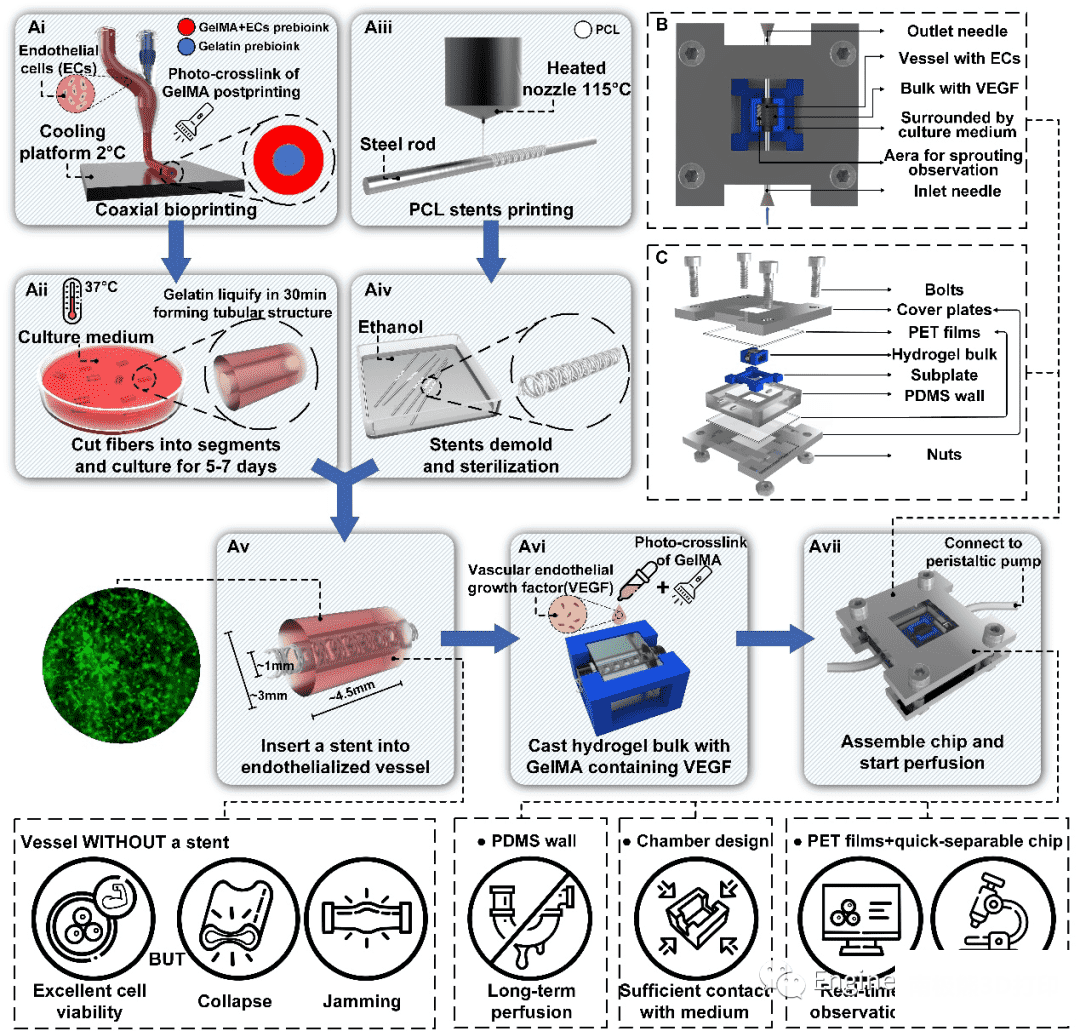
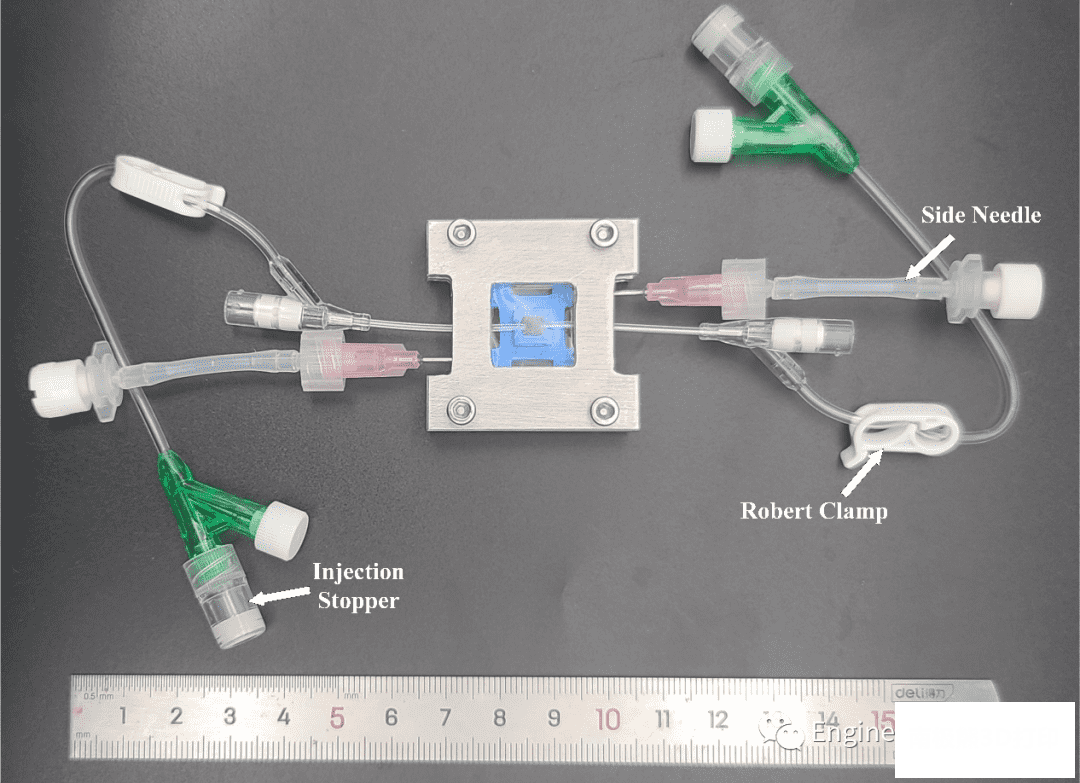
我们采用生物友好型聚合物PDMS壁和螺栓紧固的安装方式,有效地实现了长期灌流培养而无漏液、无污染。基于灌流腔室的精巧设计,装载着水凝胶块的PLA框架限位与PLA底板上,而PLA底板又与PDMS壁四角相抵,水凝胶块在灌流过程中六个方向填充着培养基,确保了水凝胶块和培养基之间全方位的充分接触,为水凝胶中的细胞提供了丰富的营养物质。空心金属盖板和透明PET薄膜的使用为血管芯片提供了一个可观察的窗口。在细胞培养监控系统的帮助下,在灌流培养过程中可实时观察内皮细胞的出芽区域。只要事先设置好合适的焦距和范围,监控系统就会从培养箱中实时传回出芽区域的图像。此外,得益于可快拆的连接接口,该模块化灌流芯片可以很容易地从灌注系统中分离出来,放在显微镜下观察,而不会造成污染。
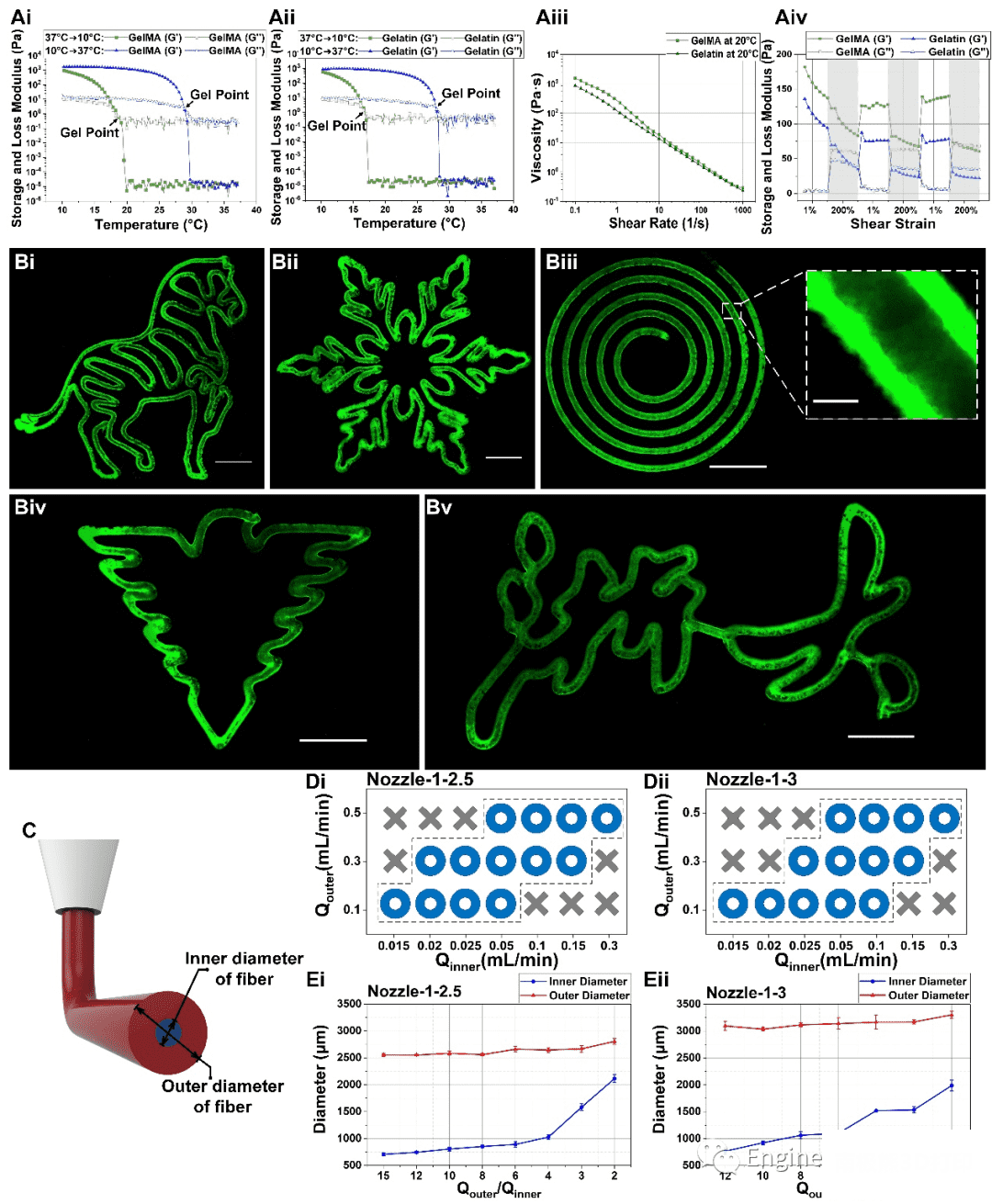
出于优化同轴生物打印过程中的打印参数、精确构建载细胞管的目的,我们分析了明胶和GelMA生物墨水的流变特性,明确了明胶/GelMA生物墨水在升温与降温过程中不同凝胶点,这为打印过程中的温度控制提供了指导。此外,流速分析也确定了最终打印的内外径流速与喷嘴的尺寸。
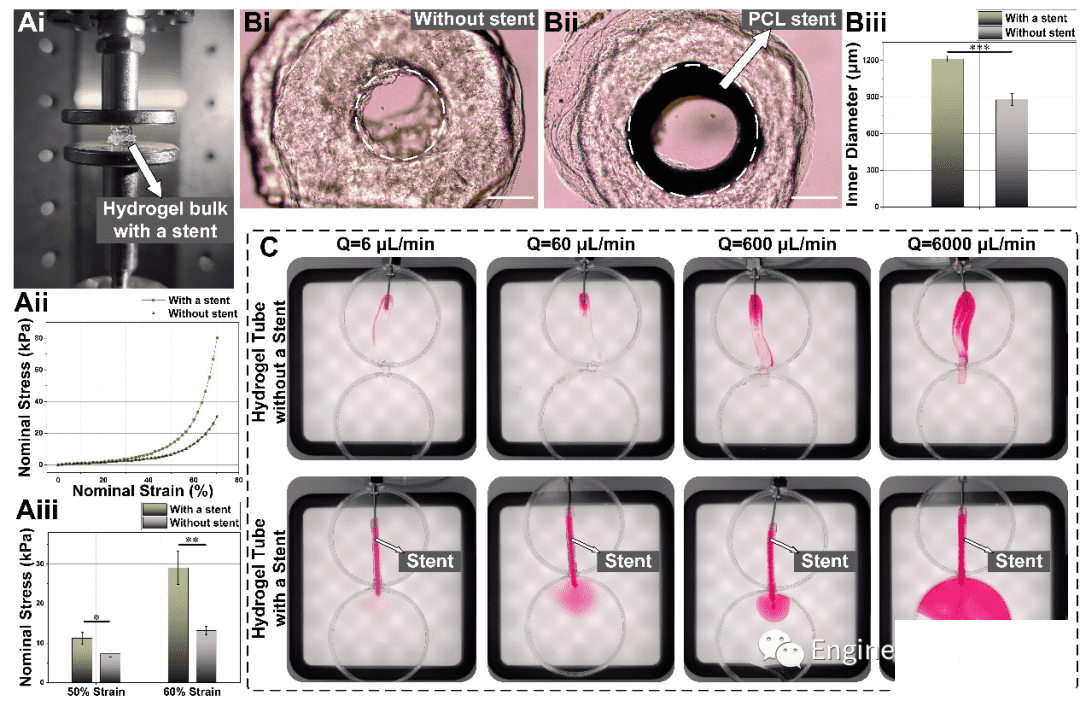
在生物3D打印中,水凝胶结构的生物相容性与结构强度一直是两个难以调和的对立面。我们在本项研究中引入了PCL支架用以支撑起柔软适合细胞生长的水凝胶结构就同时实现了良好的生物活性与灌流通道的无坍塌、无堵塞。我们从力学强度、溶胀后变形程度、不同流速的贯通测试等角度对比了有无PCL支架对水凝胶结构的影响,结果都证实了PCL支架的必要性。
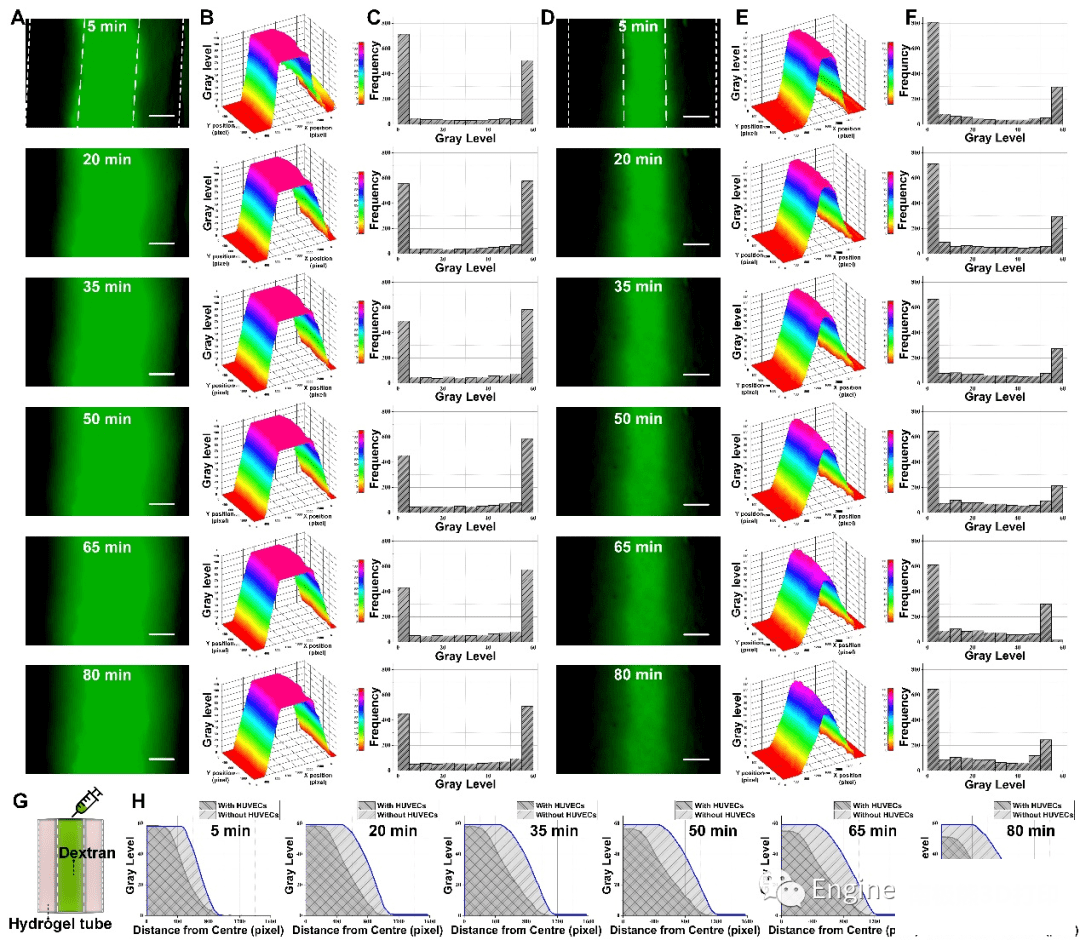
为了表征水凝胶材料的扩散渗透性和内皮化预制血管的屏障功能,我们在相同条件下测试了无细胞水凝胶管与内皮化类血管结构的FITC标记的葡聚糖扩散实验。结果表明了GelMA优秀的渗透扩散能力以及载细胞类血管结构中HUVEC之间的紧密连接已形成了良好的屏障功能。
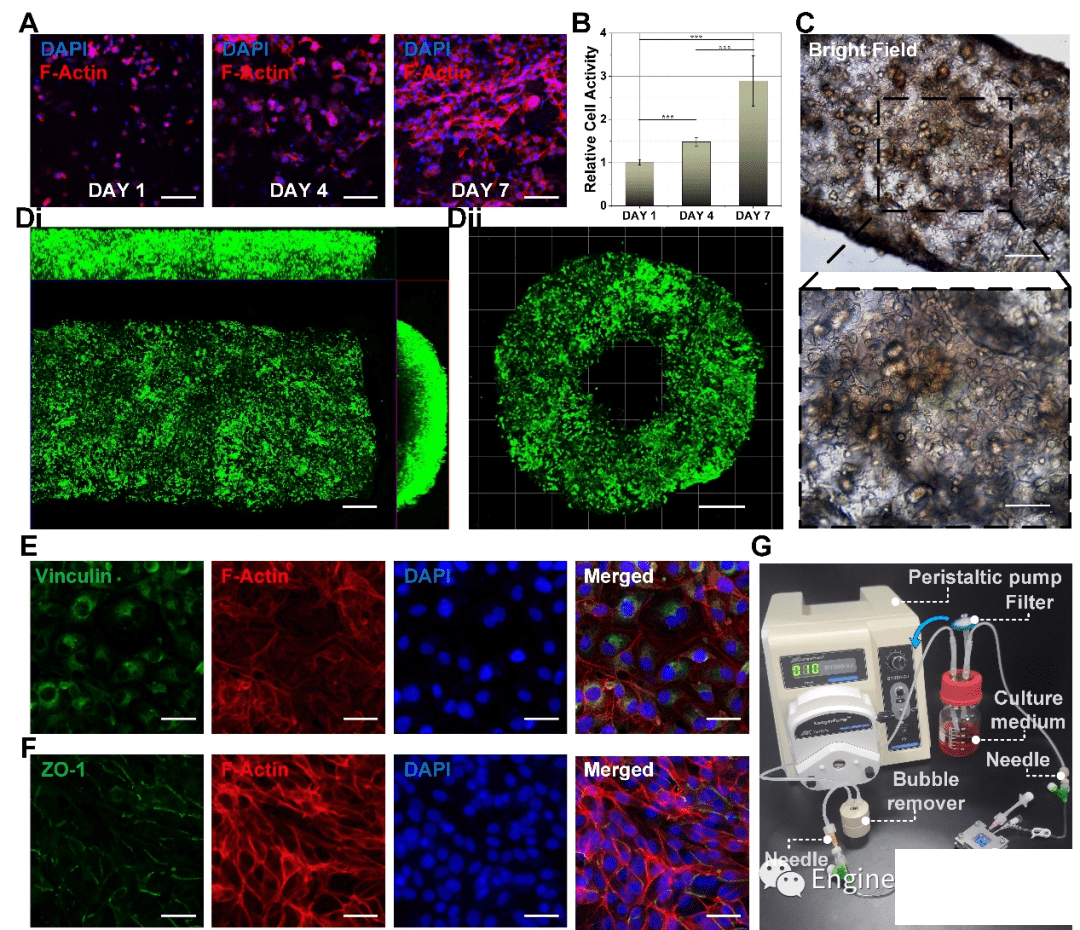
为了进一步验证该内皮化类血管结构的功能化,我们对载细胞水凝胶管进行了细胞活性表征,包括扩散、增殖分析等。该内皮化水凝胶管的三个视图和横截面视图的共聚焦图像显示了内皮细胞在生物打印的血管中均匀分布以及HUVEC之间的紧密细胞间连接。再构建完血管芯片并灌流培养3天以后,我们对载细胞水凝胶结构进行了免疫荧光染色分析。细胞外基质中的黏附蛋白vinculin的出现证实了HUVECs与水凝胶之间产生了牢固的黏附,而ZO-1抗体的表达则显示了相当紧密的细胞-细胞连接。
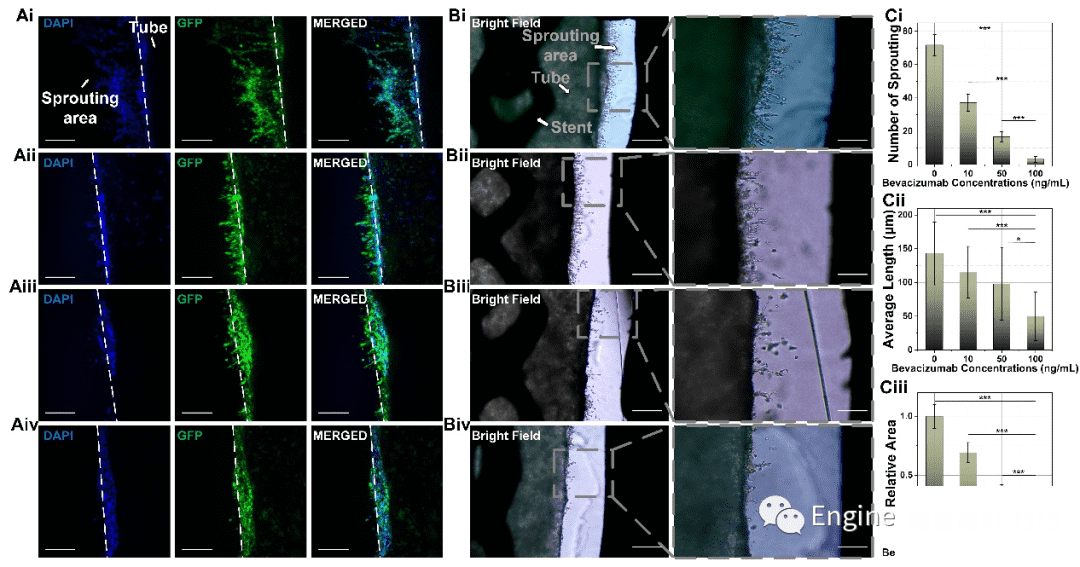
在水凝胶块浇筑时加入的VEGF(200 ng/ml)为内皮化类血管中的HUVEC提供了方向性指导,在随后的灌流培养期间,细胞感应到VEGF的梯度浓度并开始向外出芽。灌流培养3天后,通过共聚焦荧光显微镜图像和光学图像可以清楚地观察到HUVEC的出芽。在细胞培养监控系统的帮助下,在灌流的前48小时HUVEC的出芽过程被清晰地记录下来。
贝伐单抗是一种针对VEGF的重组人源化单克隆抗体,已被证明在肿瘤治疗中有效。它会抢先与VEGF结合并抑制其与VEGFR结合,从而阻止肿瘤血管的维持或发展。我们采用了三种浓度的贝伐单抗与对照组通过灌流系统进行药物筛选:10 ng/ml、50 ng/ml和100 ng/ml。灌流培养3天后,不同浓度的贝伐单抗的HUVEC出芽水平不同,与药物浓度呈负相关。对于不含贝伐单抗的对照组,HUVEC出芽旺盛,而灌注100 ng/ml贝伐单抗的样品几乎没有出芽。基于这四组模型的光学图像,我们对不同药物浓度灌流培养的HUVEC出芽还进行了定量分析。同一视野中出芽数的差异是巨大的,而出芽平均长度的差异并不大,此外出芽的相对面积也得到了评估,可能由于出芽数量存在较大差距,相对面积随着贝伐单抗浓度的变化也呈现出显著差异。
文章来源:
http://doi.org/10.18063/ijb.v8i4.619
相关研究“Perfusable Vessel-on-a-Chip for Antiangiogenic Drug Screening with Coaxial Bioprinting”近期发表在International Journal of Bioprinting杂志上,浙大机械学院顾则明博士为第一作者,浙大机械学院贺永教授和谢超淇博士后为共同通讯作者。

图1 血管新生模型的灌流系统及其生理机制
血管芯片的构建流程如下:1. 同轴生物打印载内皮细胞的水凝胶管;2. 将载细胞管切成小段并在培养箱中培养5-7天,待内皮细胞伸展、增殖形成内皮化类血管;3. 旋转打印PCL支架;4. 将PCL支架脱模并灭菌;5. 将PCL支架插入内皮化类血管结构中;6. 用含VEGF的GelMA生物墨水包裹类血管结构在预先准备的聚乳酸(PLA)框架中浇筑成水凝胶块;7. 将水凝胶块放入芯片中,连接上进出口,用螺栓紧固后即可进行灌流培养。

图2 可灌注血管芯片的构建
我们采用生物友好型聚合物PDMS壁和螺栓紧固的安装方式,有效地实现了长期灌流培养而无漏液、无污染。基于灌流腔室的精巧设计,装载着水凝胶块的PLA框架限位与PLA底板上,而PLA底板又与PDMS壁四角相抵,水凝胶块在灌流过程中六个方向填充着培养基,确保了水凝胶块和培养基之间全方位的充分接触,为水凝胶中的细胞提供了丰富的营养物质。空心金属盖板和透明PET薄膜的使用为血管芯片提供了一个可观察的窗口。在细胞培养监控系统的帮助下,在灌流培养过程中可实时观察内皮细胞的出芽区域。只要事先设置好合适的焦距和范围,监控系统就会从培养箱中实时传回出芽区域的图像。此外,得益于可快拆的连接接口,该模块化灌流芯片可以很容易地从灌注系统中分离出来,放在显微镜下观察,而不会造成污染。

图S3 可快拆的灌流芯片
出于优化同轴生物打印过程中的打印参数、精确构建载细胞管的目的,我们分析了明胶和GelMA生物墨水的流变特性,明确了明胶/GelMA生物墨水在升温与降温过程中不同凝胶点,这为打印过程中的温度控制提供了指导。此外,流速分析也确定了最终打印的内外径流速与喷嘴的尺寸。

图3 GelMA/gelatin生物墨水的可打印性分析
在生物3D打印中,水凝胶结构的生物相容性与结构强度一直是两个难以调和的对立面。我们在本项研究中引入了PCL支架用以支撑起柔软适合细胞生长的水凝胶结构就同时实现了良好的生物活性与灌流通道的无坍塌、无堵塞。我们从力学强度、溶胀后变形程度、不同流速的贯通测试等角度对比了有无PCL支架对水凝胶结构的影响,结果都证实了PCL支架的必要性。

图4 有无PCL支架支撑的对比分析
为了表征水凝胶材料的扩散渗透性和内皮化预制血管的屏障功能,我们在相同条件下测试了无细胞水凝胶管与内皮化类血管结构的FITC标记的葡聚糖扩散实验。结果表明了GelMA优秀的渗透扩散能力以及载细胞类血管结构中HUVEC之间的紧密连接已形成了良好的屏障功能。

图5 内皮化水凝胶管的屏障功能
为了进一步验证该内皮化类血管结构的功能化,我们对载细胞水凝胶管进行了细胞活性表征,包括扩散、增殖分析等。该内皮化水凝胶管的三个视图和横截面视图的共聚焦图像显示了内皮细胞在生物打印的血管中均匀分布以及HUVEC之间的紧密细胞间连接。再构建完血管芯片并灌流培养3天以后,我们对载细胞水凝胶结构进行了免疫荧光染色分析。细胞外基质中的黏附蛋白vinculin的出现证实了HUVECs与水凝胶之间产生了牢固的黏附,而ZO-1抗体的表达则显示了相当紧密的细胞-细胞连接。

图6 载细胞结构的生物活性表征
在水凝胶块浇筑时加入的VEGF(200 ng/ml)为内皮化类血管中的HUVEC提供了方向性指导,在随后的灌流培养期间,细胞感应到VEGF的梯度浓度并开始向外出芽。灌流培养3天后,通过共聚焦荧光显微镜图像和光学图像可以清楚地观察到HUVEC的出芽。在细胞培养监控系统的帮助下,在灌流的前48小时HUVEC的出芽过程被清晰地记录下来。
贝伐单抗是一种针对VEGF的重组人源化单克隆抗体,已被证明在肿瘤治疗中有效。它会抢先与VEGF结合并抑制其与VEGFR结合,从而阻止肿瘤血管的维持或发展。我们采用了三种浓度的贝伐单抗与对照组通过灌流系统进行药物筛选:10 ng/ml、50 ng/ml和100 ng/ml。灌流培养3天后,不同浓度的贝伐单抗的HUVEC出芽水平不同,与药物浓度呈负相关。对于不含贝伐单抗的对照组,HUVEC出芽旺盛,而灌注100 ng/ml贝伐单抗的样品几乎没有出芽。基于这四组模型的光学图像,我们对不同药物浓度灌流培养的HUVEC出芽还进行了定量分析。同一视野中出芽数的差异是巨大的,而出芽平均长度的差异并不大,此外出芽的相对面积也得到了评估,可能由于出芽数量存在较大差距,相对面积随着贝伐单抗浓度的变化也呈现出显著差异。

图7 抗血管新生筛药模型的应用
文章来源:
http://doi.org/10.18063/ijb.v8i4.619
(责任编辑:admin)
最新内容
热点内容


 微电热成型 (μETF)技术制
微电热成型 (μETF)技术制 Backflip推出用于3D扫描至
Backflip推出用于3D扫描至 潜力巨大,本田汽车正将3D
潜力巨大,本田汽车正将3D 最新Science子刊:生物3D
最新Science子刊:生物3D VERIGRAFT获得120万欧元Eu
VERIGRAFT获得120万欧元Eu 美国纽约大学《Biofabrica
美国纽约大学《Biofabrica 《Small Science
《Small Science 南洋理工-剑桥大
南洋理工-剑桥大 清华大学:抗拉强
清华大学:抗拉强 《Science》:一
《Science》:一 国产大尺寸陶瓷3D
国产大尺寸陶瓷3D 南京工业大学:基
南京工业大学:基

