微流控流式细胞打印技术,制备功能性肝细胞微球
时间:2022-09-02 11:57 来源: EngineeringForLife 作者:admin 阅读:次
三维培养的多细胞肝脏微球模型有利于肝纤维化治疗的发展。虽然这些模型可以再现纤维化疾病,但目前通过随机聚集产生微球方法是不受控制的,较易产生大小、功能和效用不稳定的球体。生物3D打印可以建立自动化成型,简化过程和增加可靠性。然而,舱室的加载仍然是随机的,产生了不均匀的组成和功能性质的微球。这种可变性降低了使用微球进行筛选的准确性和灵敏度。
为了实现卓越的体外肝脏建模,需要建立新的方法来创建具有可控结构、成分和功能特性的微球。近日,来自美国加利福尼亚大学的Adam R Abate团队利用微流控流式细胞打印技术(µFCP)成功制造了精密肝脏细胞微球。所产生的细胞球体具有优越的功能均匀性,与随机生成的球体相比,具有更准确的统计窗口。相关研究以“Controlled fabrication of functional liver spheroids with microfluidic flow cytometric printing”为题于2022年8月2日在线发表在Biofabrication上。
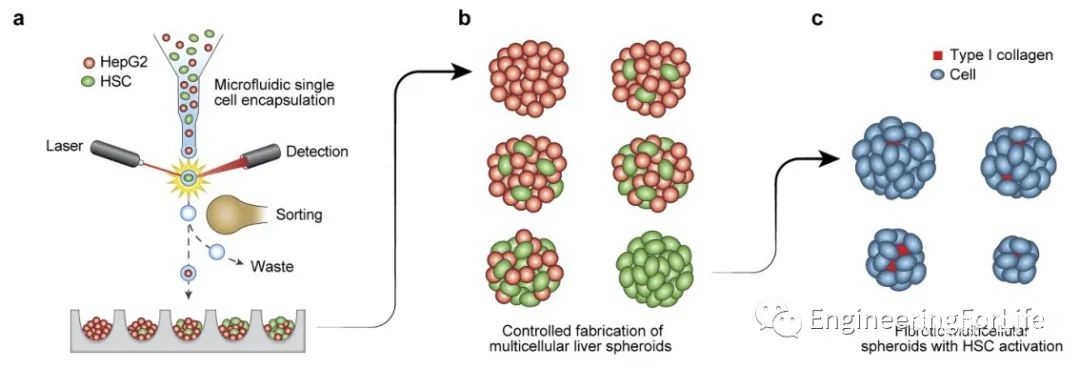
图1 微流控流式细胞打印技术产生肝细胞微球示意图
首先,作者将肝细胞(HepG2)细胞经胰蛋白酶处理后,通过26G针三次,使细胞团块断裂,制成单个HepG2细胞悬液。同样,肝星状细胞(HSC)也经胰酶和EDTA消化为单细胞悬液。基于微流控芯片开发的单细胞打印机可通过定制的LabVIEW界面实现自动化。作者采用康宁的6孔或384孔的圆底超低粘附微孔板作为印刷或被动加载基板。利用悬浮细胞制备细胞微球的一个挑战是,不是所有的细胞都是活的。因此,使用随机分隔技术,死亡的细胞包含在种子中,引入可以改变球形性质的可变性。用活性染料可以丢弃死细胞,这是一种独特而有价值的特性(图2)。

图2 与随机沉淀法相比,产生的细胞存活率和均匀度更高
球形大小由培养时间和种子中起始细胞的数量决定。为了说明µFCP在控制球体大小方面的效用,作者打印出具有不同细胞数量的种子,并监测它们的生长,与随机加载相比,最终的大小变异性要小约3倍。为了说明准确控制其成分的能力,我们使用两种方法构建了含有10个HepG2和10个造血干细胞的目标成分的球体。对于µFCP, HepG2细胞平均10.4个,HSC细胞平均10.1个,标准误差分别为0.9和0.8。对于随机加载,根据泊松分布,我们观察到HepG2细胞平均数量为9.4,HSC细胞平均数量为9.9,标准误差分别为3.4和3.6。因此,印刷的球体比随机加载产生的球体尺寸变异性低三倍。
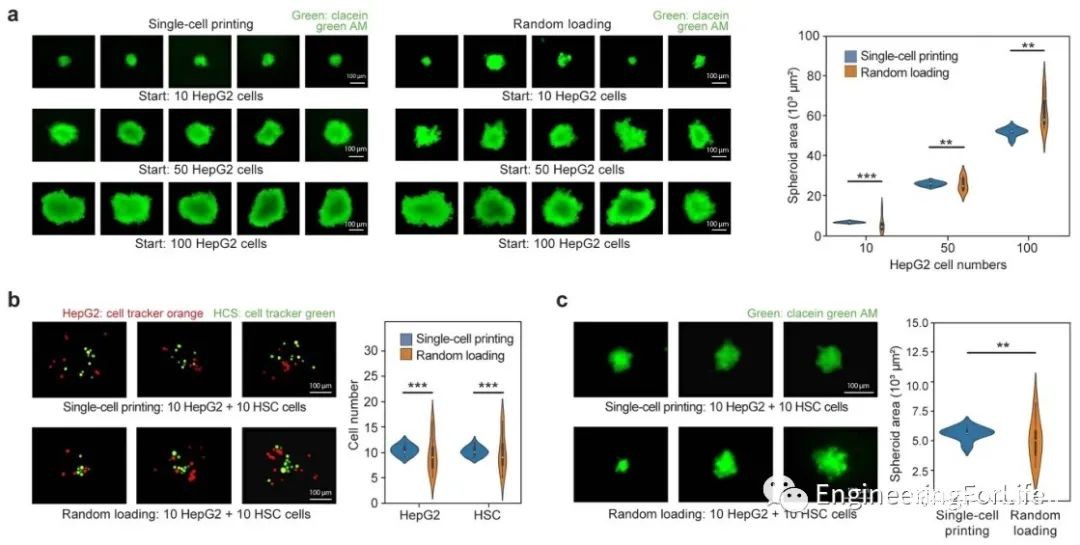
图3 采用微流控单细胞打印技术制备多细胞肝球,得到更加均匀的多细胞肝脏微球
纤维形成依赖于肝细胞与造血干细胞的相互作用。因此,这些细胞的比例变化可导致不规则的球形功能。为了研究细胞比例对肝球形表型和纤维化模型的影响,作者打印了不同比例的HepG2和HSC,每个球形有100个细胞。培养6天后,观察到球体大小随着HSC数量的增加而减小。随着HSC数的进一步增加,紧致度渐近,球体的形状变得不规则。造血干细胞增加超过60%会导致非生理状态和次优球体。为了更深入地研究这一问题,作者量化了球形胶原蛋白的生成,这是纤维化中的关键功能性生物标志物。在50%以下,总胶原蛋白随星状细胞数量线性增加,每个星状细胞产生的胶原蛋白数量大致不变(图4)。
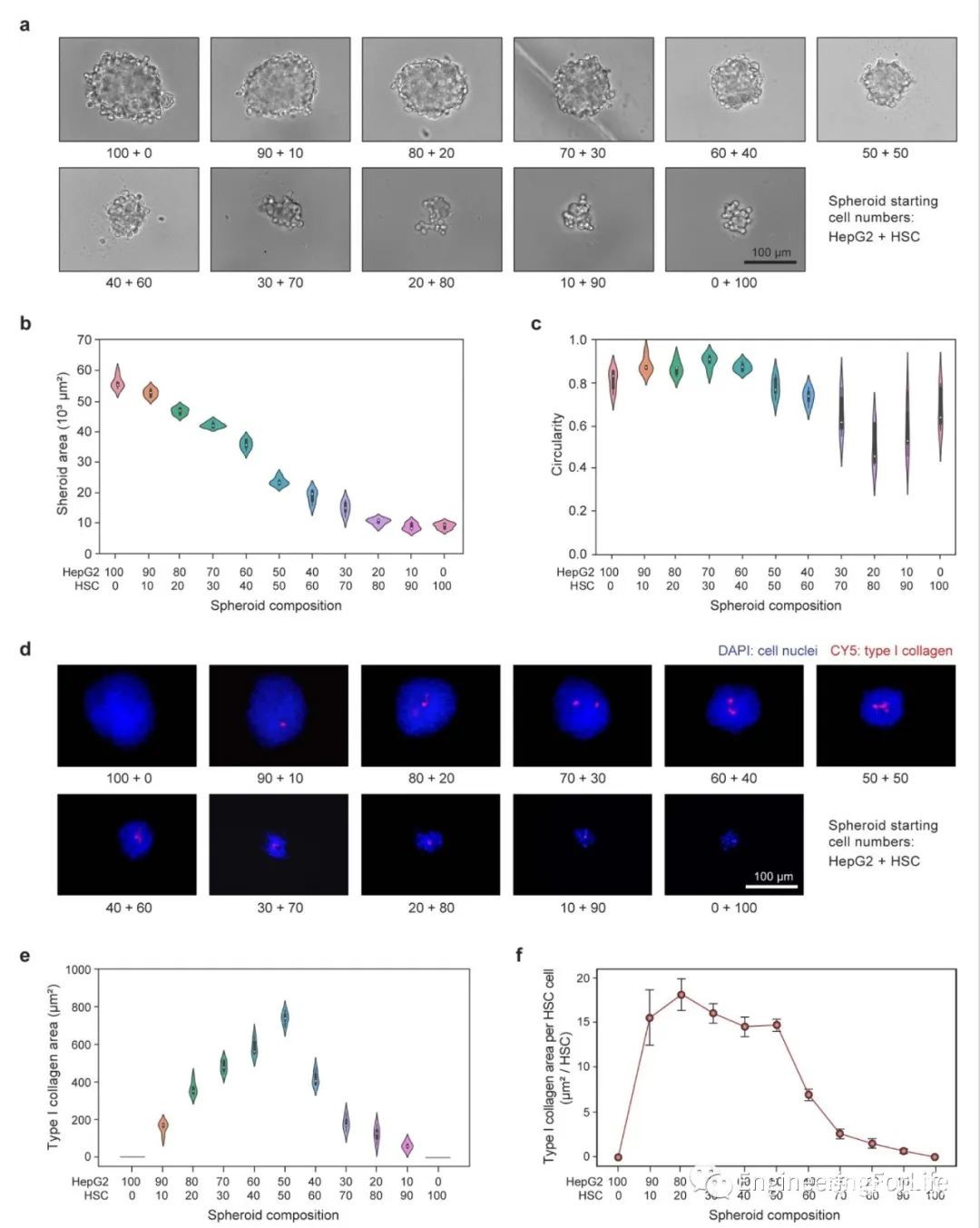
图4 肝细胞微球细胞型比例的系统研究
使用细胞微球进行药物筛选时,其大小和功能的均匀性直接影响准确性。由于µFCP可以制备均匀性的微球体,与随机技术相比,它可以提供更精确的筛选。为了评估药物反应的可变性,我们使用TGF-β1促纤维化化合物处理微球,这是一种有效的星状细胞激活刺激方式,导致I型胶原的产生。为了比较功能均匀性,我们通过计算I型胶原的面积来量化I型胶原的数量。实验表明,TGF-β1显著增加了打印的球状体和随机生成的球状体中的I型胶原,与随机生成的相对标准误差测量相比,打印出来的球体导致测量变异性降低,测量可变性大大增加了药物影响的统计显著性(图5)。
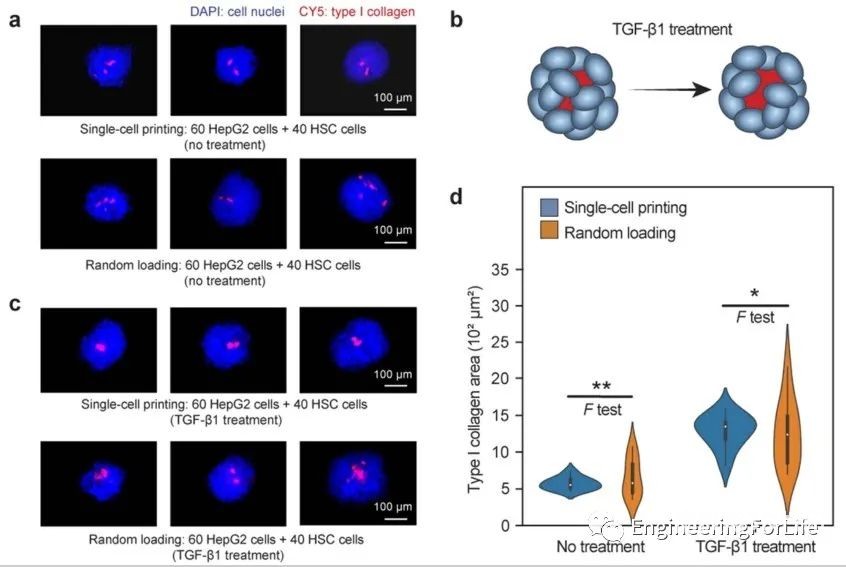
图5 单细胞打印肝细胞微球利于准确的体外药效评价
基于随机聚集所产生的肝细胞微球具有可变的尺寸和功能的缺点,限制了它们再现肝脏生物学和纤维化的可重复性,以及使用它们作为组织模型进行药物筛选的准确性。本文所提出的微流控单细胞打印方法克服了这些问题,肝细胞微球是由所需精确数量的细胞类型和高活力的细胞组成。将多路复用技术与单细胞精度相结合,可以精确地制作出设计复杂度更高的细胞微球,这将有助于研究如何控制细胞微球的性质或引入新的功能特性。
文章来源:
https://doi.org/10.1088/1758-5090/ac8622
为了实现卓越的体外肝脏建模,需要建立新的方法来创建具有可控结构、成分和功能特性的微球。近日,来自美国加利福尼亚大学的Adam R Abate团队利用微流控流式细胞打印技术(µFCP)成功制造了精密肝脏细胞微球。所产生的细胞球体具有优越的功能均匀性,与随机生成的球体相比,具有更准确的统计窗口。相关研究以“Controlled fabrication of functional liver spheroids with microfluidic flow cytometric printing”为题于2022年8月2日在线发表在Biofabrication上。

图1 微流控流式细胞打印技术产生肝细胞微球示意图
首先,作者将肝细胞(HepG2)细胞经胰蛋白酶处理后,通过26G针三次,使细胞团块断裂,制成单个HepG2细胞悬液。同样,肝星状细胞(HSC)也经胰酶和EDTA消化为单细胞悬液。基于微流控芯片开发的单细胞打印机可通过定制的LabVIEW界面实现自动化。作者采用康宁的6孔或384孔的圆底超低粘附微孔板作为印刷或被动加载基板。利用悬浮细胞制备细胞微球的一个挑战是,不是所有的细胞都是活的。因此,使用随机分隔技术,死亡的细胞包含在种子中,引入可以改变球形性质的可变性。用活性染料可以丢弃死细胞,这是一种独特而有价值的特性(图2)。

图2 与随机沉淀法相比,产生的细胞存活率和均匀度更高
球形大小由培养时间和种子中起始细胞的数量决定。为了说明µFCP在控制球体大小方面的效用,作者打印出具有不同细胞数量的种子,并监测它们的生长,与随机加载相比,最终的大小变异性要小约3倍。为了说明准确控制其成分的能力,我们使用两种方法构建了含有10个HepG2和10个造血干细胞的目标成分的球体。对于µFCP, HepG2细胞平均10.4个,HSC细胞平均10.1个,标准误差分别为0.9和0.8。对于随机加载,根据泊松分布,我们观察到HepG2细胞平均数量为9.4,HSC细胞平均数量为9.9,标准误差分别为3.4和3.6。因此,印刷的球体比随机加载产生的球体尺寸变异性低三倍。

图3 采用微流控单细胞打印技术制备多细胞肝球,得到更加均匀的多细胞肝脏微球
纤维形成依赖于肝细胞与造血干细胞的相互作用。因此,这些细胞的比例变化可导致不规则的球形功能。为了研究细胞比例对肝球形表型和纤维化模型的影响,作者打印了不同比例的HepG2和HSC,每个球形有100个细胞。培养6天后,观察到球体大小随着HSC数量的增加而减小。随着HSC数的进一步增加,紧致度渐近,球体的形状变得不规则。造血干细胞增加超过60%会导致非生理状态和次优球体。为了更深入地研究这一问题,作者量化了球形胶原蛋白的生成,这是纤维化中的关键功能性生物标志物。在50%以下,总胶原蛋白随星状细胞数量线性增加,每个星状细胞产生的胶原蛋白数量大致不变(图4)。

图4 肝细胞微球细胞型比例的系统研究
使用细胞微球进行药物筛选时,其大小和功能的均匀性直接影响准确性。由于µFCP可以制备均匀性的微球体,与随机技术相比,它可以提供更精确的筛选。为了评估药物反应的可变性,我们使用TGF-β1促纤维化化合物处理微球,这是一种有效的星状细胞激活刺激方式,导致I型胶原的产生。为了比较功能均匀性,我们通过计算I型胶原的面积来量化I型胶原的数量。实验表明,TGF-β1显著增加了打印的球状体和随机生成的球状体中的I型胶原,与随机生成的相对标准误差测量相比,打印出来的球体导致测量变异性降低,测量可变性大大增加了药物影响的统计显著性(图5)。

图5 单细胞打印肝细胞微球利于准确的体外药效评价
基于随机聚集所产生的肝细胞微球具有可变的尺寸和功能的缺点,限制了它们再现肝脏生物学和纤维化的可重复性,以及使用它们作为组织模型进行药物筛选的准确性。本文所提出的微流控单细胞打印方法克服了这些问题,肝细胞微球是由所需精确数量的细胞类型和高活力的细胞组成。将多路复用技术与单细胞精度相结合,可以精确地制作出设计复杂度更高的细胞微球,这将有助于研究如何控制细胞微球的性质或引入新的功能特性。
文章来源:
https://doi.org/10.1088/1758-5090/ac8622
(责任编辑:admin)
最新内容
热点内容


 Fabric8Labs推出AI芯片定
Fabric8Labs推出AI芯片定 Titomic又一合作,将与nuF
Titomic又一合作,将与nuF 荷兰公司将开设3D打印船舶
荷兰公司将开设3D打印船舶 Chicago Additive推出AMOS
Chicago Additive推出AMOS 590MHz带宽+超90%辐射效率
590MHz带宽+超90%辐射效率 威斯康星大学麦迪逊分校工
威斯康星大学麦迪逊分校工 突破性生物3D打印
突破性生物3D打印 迪拜LEAP 71公司
迪拜LEAP 71公司 3D生物打印构建内
3D生物打印构建内 《Small Science
《Small Science 南洋理工-剑桥大
南洋理工-剑桥大 清华大学:抗拉强
清华大学:抗拉强

