高分辨率3D打印活性酶催化载体,通过精细结构提高连续催化反应器合成效率
在生物化工领域中,酶催化反应因其高效性和对合成环境的相对宽容性而闻名,常用于合成和加工经济价值高且难以通过传统化学合成途径获取的化合物。然而,酶催化反应所需的活性酶往往价格不菲,且在传统合成流程中不易分离,这不仅造成了资源的严重浪费,还使得酶催化流程的成本控制成为一大挑战。因此,学术界致力于探索将活性酶负载于催化载体的方法,通过构建连续催化反应器,使反应物连续流经并接触载体上的活性酶,从而实现连续化生产。这一方法避免了酶直接进入反应液,省去了后续的分离步骤,提高了酶的利用效率和经济性。但此模式亦存在加工效率不高的问题,原因是酶未直接置于体系中,与反应物的接触面积受限,使得合成效率不及直接在体系中分散酶的方法。
3D打印技术的兴起为生物基连续催化反应器的制造带来了新契机。该技术允许用户精确制备催化载体的三维空间结构,从而最大化载体中的活性酶与反应物的接触面积,进而提升反应器的生产效率。近年来,已有研究通过将活性酶催化剂固定于高分子水凝胶网络中的方法,成功制造了有催化活性的载体结构。然而,这类结构所面临的一个主要挑战是反应物难以充分接触载体内部的活性酶:由于受限于基材的扩散性能,往往仅有表面的酶能有效地发挥催化作用,导致内部酶的利用不充分。
针对这一问题,来自诺丁汉大学的研究团队采用摩方精密面投影微立体光刻(PμSL)3D打印技术及创新的水凝胶配方,在保持催化酶活性的前提下,成功制造出精度高达10 μm的精细催化载体结构。这一突破显著增强了催化载体与反应物的接触,进而提升了整个系统的催化效率。相关成果以“High resolution 3D printed biocatalytic reactor core with optimized efficiency for continuous flow synthesis”为题发表在期刊《Chemical Engineering Science》上。

该文章中的生物催化反应器芯是利用摩方精密nanoArch® S130(精度:2 μm)3D打印设备直接打印加工而成。文中使用的光固化配方由聚乙二醇二丙烯酸酯(PEGDA),苯基磷酸锂(LAP),柠檬黄和β-半乳糖苷酶配置而成,能够实现最小10 μm的孔道结构,并具有高保真度的最小50 μm的方形流道。相较于无流道结构,通过PμSL技术加工的三维酶基催化剂实现了提升催化效率,最高可达60%,并且通过将静态反应器修改成动态连续反应器的方式,整个动态催化系统的催化效率相较于静态催化系统提高了240%。
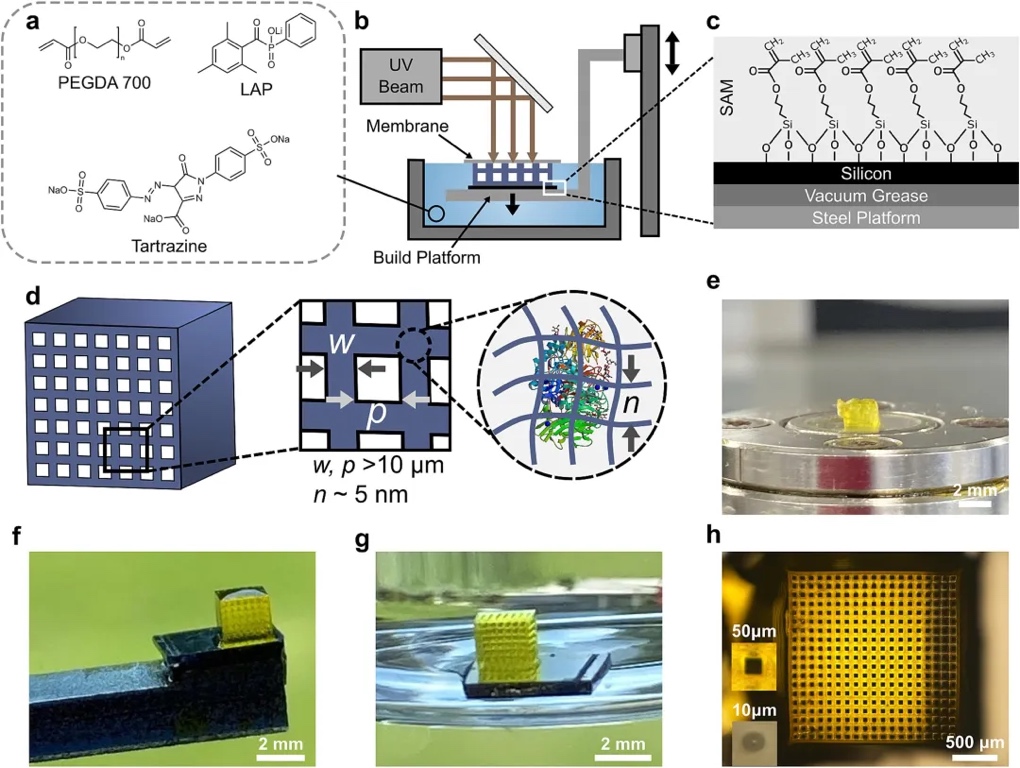
实验表明,β-半乳糖苷酶在未固化的聚乙二醇二丙烯酸酯中暴露160分钟后,仍能保留80±10%的活性。同时,通过测量打印件浸泡在缓冲液中上清液的活性发现,β-Gal被水凝胶包裹后几乎没有渗出,这进一步证明了该方法的有效性。
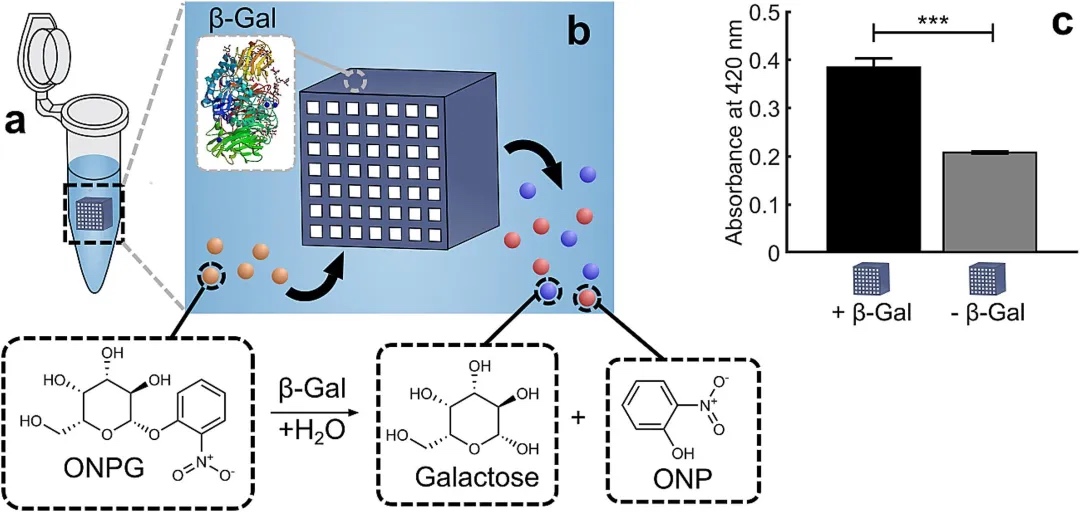
团队人员在非流动条件下对含β-半乳糖苷酶的催化结构活性进行了初步评估。以边长为2 mm的立方体、水平排列7×7 通道(通道宽度150μm、壁厚100 μm)的反应器核心为例。分光光度法结果显示,420 nm处含酶的反应器核心产生的产物信号明显强于不含酶的样本,证明了该反应器核心用于酶催化的可行性。
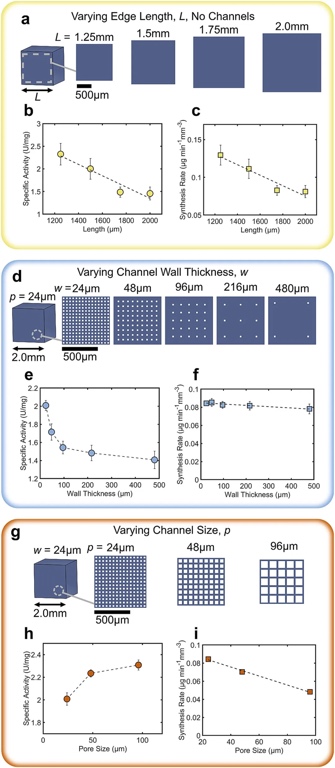
随后,文章探讨了不同打印结构对反应器性能的影响。以无通道的立方体为参考样本,结果表明随着催化结构的边长增加,比活性和合成速率均降低。这是因为催化核心尺寸增大时,位于中心区域的酶与反应物之间的扩散路径变长,导致酶的利用效率降低,同时产物扩散也受到阻碍。这表明传统无通道反应器在扩大规模生产的过程中,若不解决酶活性中心的可及性问题,增加体积会导致产量迅速达到瓶颈。
基于上述现象,为进一步改善反应物扩散和酶可及性问题,团队尝试在反应器核心中设计通道。初步固定通道宽度为24 μm,改变反应器核心的壁厚度(24 μm - 480 μm),观察到壁厚从480 μm减小到24 μm时,比活性提高约40%,其中壁厚度小于100 μm 时提升尤为显著。而这一尺度是传统3D打印难以实现的,再次证明PμSL技术运用于该类结构的生产优势。实验观察到合成速率并未随壁厚度减小而显著增加,这是因为减小壁厚度虽缩短了扩散路径提高了合成速率,但也减少了酶的总质量,二者存在权衡关系。进一步的研究表明,固定壁厚度为24 μm,改变通道宽度(24 μm- 96 μm)时,比活性增加15%,原因是较大通道利于热对流,使底物更快到达水凝胶中心,从而增加了底物与酶的接触机会。然而,合成速率却下降了43%,主要原因为通道尺寸增大导致打印水凝胶体积减小,进而使得酶质量随之减少。
综合实验结果,为了最大化比活性,采用薄通道壁和大孔隙组合可使比活性提高60% ,但就会导致在流动条件下大孔隙重要性降低。而对于小型反应器核心而言,较小孔隙和增加酶质量更利于提高合成速率。此外,分析表明比活性和合成速率与宏观表面积相关性较差,高分辨率3D打印可精确控制分子在水凝胶中扩散的最大路径长度,进而优化生物催化反应器性能。
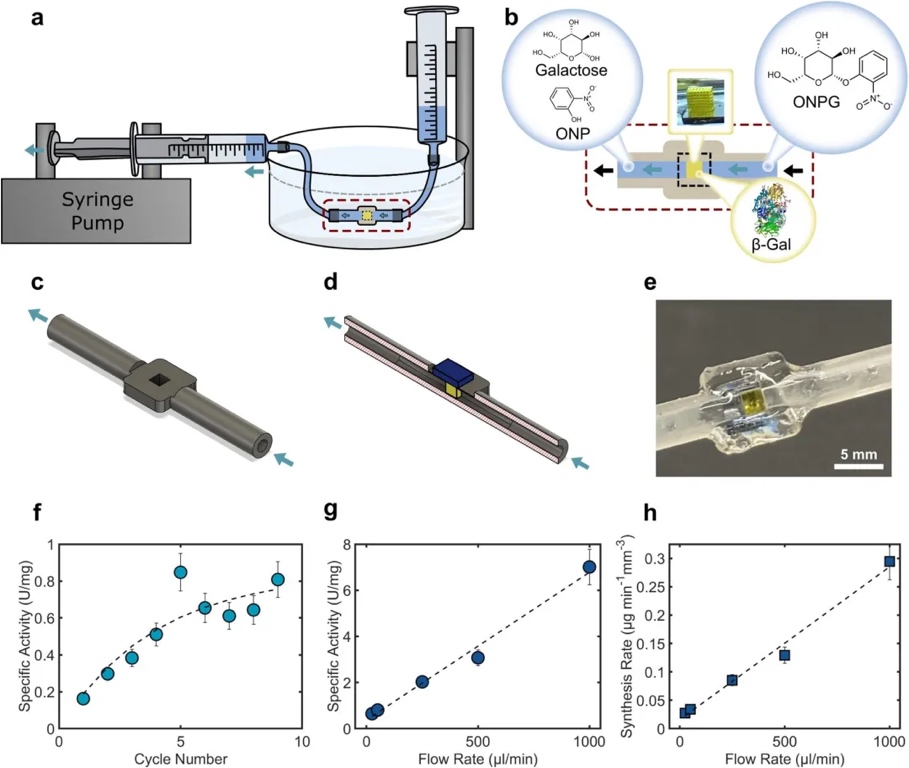
接下来,团队设计并打印了一套完整的连续流反应器。组装完成后,研究人员先以50 μL/min 的流速将500 μL反应物溶液注入反应器,并重复9次循环。实验初期,由于反应器需要时间建立稳定的反应物和产物流动状态,输出的比活性较低(0.16 μmol·min-1·mg-1)。但随着循环次数的增加,反应器逐渐达到稳态,比活性也逐渐升高,最终达到约0.8 μmol·min-1·mg-1并趋于稳定。
在比活性稳定后,文章进一步探究流速对反应器性能的影响。控制流速在 25-1000 μL/min 范围内并保持500 µL的反应物总量。实验结果表明比活性随着流速的增加而不断提高。当最高流速1000 μL/min时,比活性达到 7.0 μmol·min-1·mg-1,相比静态实验中获得的最高比活性提高了200% 以上,且有效因子达到64%。这一结果与前期文献中使用的3D挤出法(<7%)和3D喷射法(21.2%)的结果相比,有显著的提升。合成速率也呈现出随流速增加而上升的趋势。在流速为1 mL/min 时,合成速率达到最大值0.29 μg·min-1·mm-3,相比静态实验提高了240%。综上所述,在低转化率下,比活性/合成速率与流速呈线性比例关系,由于底物在主体流动中的浓度相对稳定,流速成为控制合成速率的关键因素。但仍存在大量试剂未反应就流过通道的问题。这也表明当前反应器在底物利用效率方面还有提升的空间。
总结:该研究运用高精度面投影微立体光刻 (PμSL) 3D 打印技术,打印高分辨率 (10 μm)、高保真、酶活性水凝胶反应器核心。相较于无通道的3D打印部件,该结构成功将比活性提升60%,在小于100 μm 尺度实现效率突破,证明高分辨率3D打印可优化反应器性能。同时,构建的3D打印连续生物催化流动反应器性能突出。在最高流速下合成速率相比静态实验提升240%,有效因子达64%。并且,小型反应器理论的时空产率较好,满足商业高价值产品生产要求,若能放大规模,有望推动药物制造向更可持续的方向发展,为生物催化领域带来新的突破。
原文链接:https://doi.org/10.1016/j.ces.2024.121156
(责任编辑:admin)


 重磅:AI开源大风刮到自动
重磅:AI开源大风刮到自动 增材制造助力半导体产业:
增材制造助力半导体产业: 非粉末床金属增材制造综述
非粉末床金属增材制造综述 生物3D打印载细胞微球治疗
生物3D打印载细胞微球治疗 突破:特种钢细粉收得率达
突破:特种钢细粉收得率达 赋能绿色能源装备长效运行
赋能绿色能源装备长效运行 选区激光熔化增材
选区激光熔化增材 大型聚合物3D打印
大型聚合物3D打印 6K Additive最新
6K Additive最新 如何打造增材制造
如何打造增材制造 从实验室走向生产
从实验室走向生产 3D打印在口腔修复
3D打印在口腔修复

