生物3D打印皮肤的研究进展及多样化临床应用路径
时间:2023-12-20 09:25 来源:中国老年医学学会烧创伤分会 作者:黄沙 阅读:次
近年来,生物3D打印技术在皮肤替代物研究中的快速发展引起了广泛关注。与传统组织工程皮肤相比,生物3D打印技术能够更快速、全面地模拟皮肤的结构和功能,为多种实验检测和临床用途提供支持,由此也推动了皮肤替代物的快速迭代。生物3D打印皮肤的应用路径、场景和方向呈现多样化。除了传统的体外培养加创面移植的临床路径,还可以采用原位打印光聚合的形式进行快速床旁构建,用于创面急救与治疗。此外,结合现有临床治疗方法,生物3D打印皮肤可以为患者提供更精确和定制化的解决方案。未来的研究将聚焦于生物墨水的改进、打印技术的优化以及临床应用的推广,以实现生物3D打印皮肤技术在创面治疗中的广泛应用。
实现皮肤的完美再生一直是现代医学追求的目标。然而,传统的自体皮移植由于供体来源的限制、供体部位的缺陷、免疫排斥和感染等因素的存在,其应用范围受到一定程度的限制[1]。此外,现有的创面敷料只适用于浅表创面的促愈治疗,无法处理大面积和深部创面。因此,从20世纪80年代开始,基于组织工程的皮肤替代物构建引起了广泛关注并迅速发展。然而,由于技术的局限性,目前的组织工程皮肤在结构和功能上相对简单,难以满足临床实际需求[2]。
进入21世纪,随着生物3D打印技术的兴起,为皮肤替代物的研究带来了新的机遇。生物3D打印技术是以计算机三维模型为模板,装配特制“生物墨水”,最终制造出人造器官和生物医学产品的新科技手段。从2007年的概念兴起到现在,这项技术经历了飞速发展,目前已成为了最热门、最具有应用前景的组织工程技术,促使再生医学研究与转化提升到了一个新高度[3]。
相较于传统的组织工程技术,生物3D打印技术具有按需构建特殊形状和复杂结构的皮肤替代物的能力,并且具有更高的精度[4]。近年来,生物3D打印皮肤相关的生物墨水基础生物材料的开发、以及结构功能的整合研究等均取得了迅速进展,逐步实现了皮肤结构和功能的多样性构建。同时,基于不同的生物3D打印皮肤构建策略,衍生出了多种生物3D打印皮肤替代物的临床使用场景和路径,以满足不同的创面治疗需求。这意味着生物3D打印皮肤替代物可以更好地适应不同类型的创面,为患者带来更加个性化、精准的治疗方案。本文旨在对生物3D打印皮肤的最新研究进展进行简要概述,并探讨其在临床应用中的多重潜在路径,以期为未来的研究和临床应用提供明确定位和发展方向。
1. 生物3D打印皮肤的研究进展
由于皮肤具有简单层状平面的生理结构,因此在生物3D打印研究中具有天然优势[5]。经过十多年的研发,国内外多个研究团队已经发表了生物3D打印皮肤的研究进展。生物3D打印皮肤已经在许多方面超越了传统组织工程皮肤,其结构和功能模拟更加快速且全面,应用路径、应用场景和应用方向呈现多样化[6]。
在打印结构方面,生物3D打印皮肤不仅可以包含传统组织工程皮肤的层状(表皮层、真皮层和皮下组织层)结构,而且可以将具有特殊功能的细胞(如黑素细胞、朗汉细胞等)和结构模块精准嵌入皮肤中,从而实现皮肤的全结构再造。Ng等[7]报道了含有表皮细胞、黑素细胞和成纤维细胞的仿生3D打印皮肤模型,该皮肤的色素沉着较普通组织工程皮肤更能模拟人体正常皮肤的色素水平(如图1A)。Atala等[8]报道了含有6种皮肤相关细胞和三层结构的生物3D打印皮肤,在体外培养56天达到成熟后移植入裸鼠背部创面,实现创面的快速愈合(如图1B)。
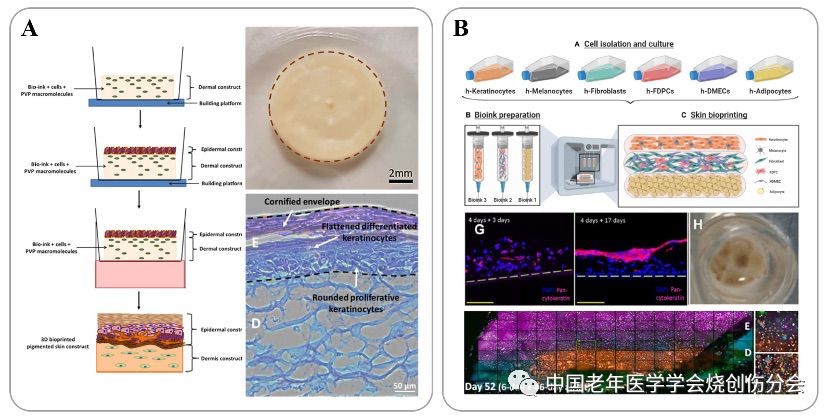
在功能重建方面,生物3D打印皮肤不仅可以通过装载入打印组织的特殊功能细胞和附属器实现特定功能,而且还可以根据植入后血管神经长入的需求,在特定部位加入血管、神经的种子细胞或活性诱导因子,可有效增强打印皮肤的成活率。Abaci等[9]报道了含有毛囊仿生结构的生物3D打印皮肤,且在裸鼠背部创面移植后长出毛发。Huang等[10]报道了生物3D打印皮肤中诱导间充质干细胞向汗腺分化,并将该打印皮肤用于小鼠足掌烧伤创面治疗并促进该部位汗腺功能重建。
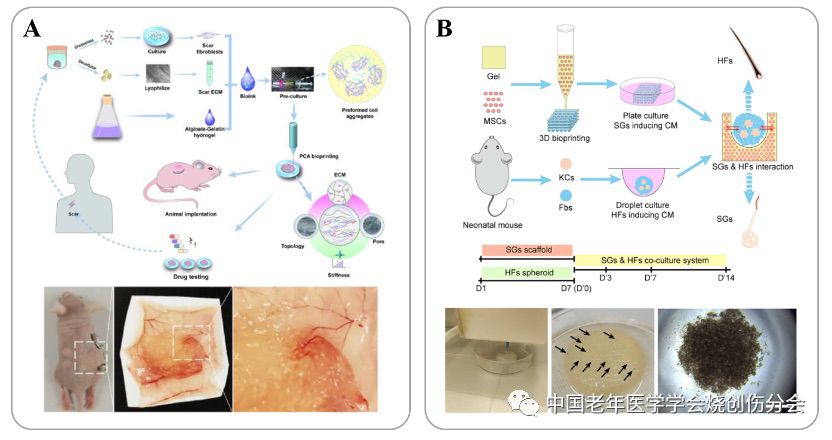
另外,皮肤附属器和皮肤疾病的体外研究模型构建也取得了很多进展。Yao B.等[12]还将人源性瘢痕细胞和瘢痕细胞外基质混入生物墨水,打印出的组织体外培养后移植入裸鼠背部,形成了表征稳定的人源性瘢痕类器官,可用于瘢痕形成机制研究和药物筛选(如图2A);Zhang Y.等[11]利用悬滴培养法构建了毛囊细胞球,将该细胞球种植于前期制备成熟的含有诱导汗腺组织的生物3D打印皮肤内,构建出同时含有汗腺和毛囊的生物3D打印皮肤,可以用于皮肤和汗腺相互作用机制的基础研究(如图2B)。
2. 生物3D打印皮肤的临床应用路径
随着技术的不断进步和临床实践的积累,生物3D打印皮肤在临床应用中的潜力逐渐展现。相比传统组织工程皮肤,生物3D打印皮肤具有更多可选择的临床应用路径。
首先,绝大部分生物3D打印皮肤可以使用与传统组织工程皮肤相同的临床路径,即将生物3D打印皮肤在体外培养至成熟状态,然后再移植到患者的创面上[8,13]。这种方法可以确保打印皮肤具备足够的结构完整性,同时也提供了更多的时间进行细胞和组织的诱导培养和功能成熟。这种传统的应用路径在一些复杂创面重建术中已经得到应用,但是由于体外诱导培养需要较高的实验条件,培养时间一般较长,而且存在打印结构降解和污染的风险,所以流程复杂性可能会影响该临床路径的广泛应用。
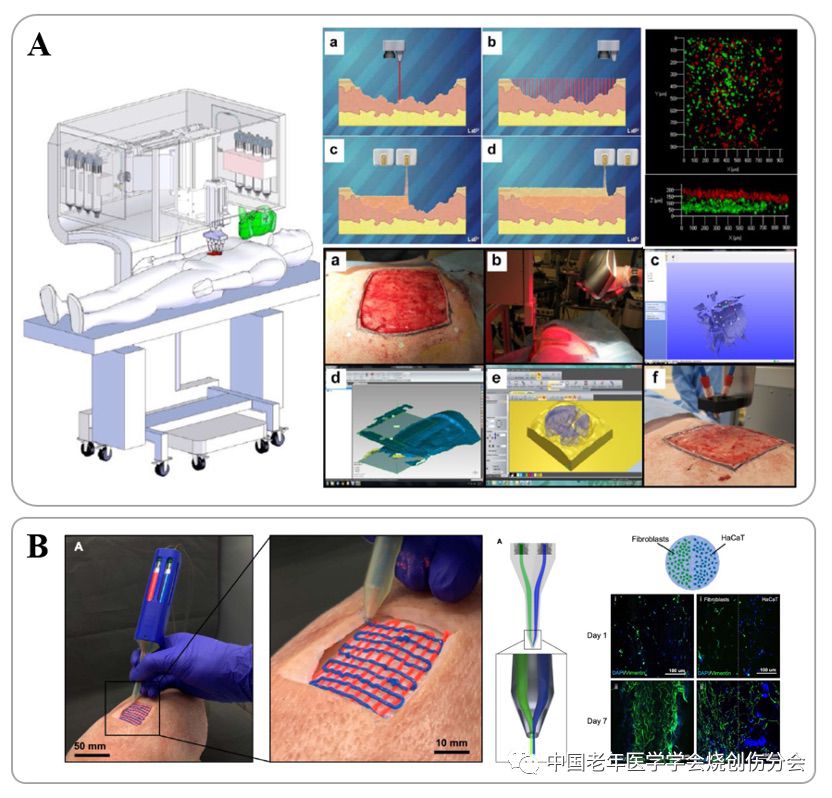
近年来,随着光聚合材料的快速推广,临床即用型生物3D打印技术也快速在皮肤再生领域得到了应用[14]。Albanna等将三维扫描和在创面原位打印并光聚合构建双层皮肤的方法在实验动物模型中进行了全流程模拟,并取得了良好的创面治疗效果[15](如图3A)。这个临床路径应用了目前最先进的三维扫描仪、光聚合生物材料(GelMA、HAMA等改性高分子材料和LAP等光引发剂)以及手持式生物3D打印机[16](如图3B),脱离了实验室环境,达到了床旁快速的皮肤3D打印和即时使用的效果,避免了传统路径中体外培养过程中的变形和污染风险。
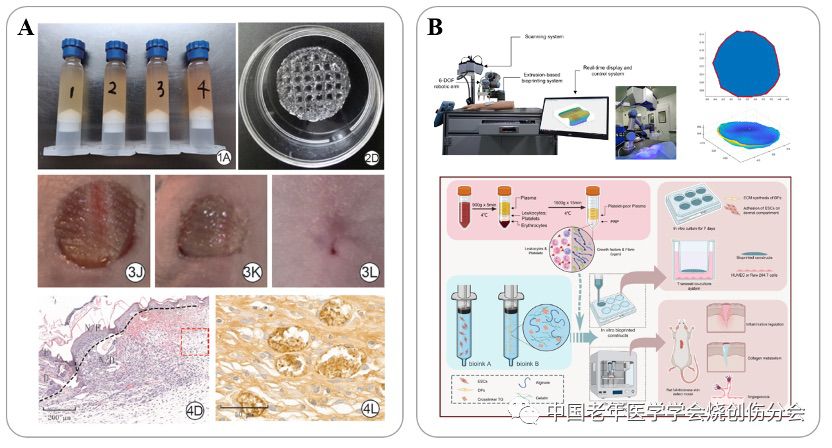
除此之外,生物3D打印还可以与现有治疗技术结合,为患者提供更为精确和定制化的解决方案。自体采集的富血小板血浆(PRP)含有创面愈合所需的多种生长因子,因此常用于创面治疗,传统的用法是将其与氯化钙或者凝血酶混合,在创面形成凝胶并激活血小板释放生长因子,但是这种应用方法的血小板用量较大,并且由于血小板没有保护在创面释放后生物活性衰减迅速。针对血小板在创面应用中存在的这些问题,宋薇等将PRP与生物3D打印技术结合,用于小鼠创面模型的治疗,使得创面血管化显著增强而且创面愈合加速的效果[17]。Zhao M等还将创面三维扫描和打印路径设计等工程技术与含PRP的生物3D打印结合用于创面治疗[18]。除了可以结合PRP以外,生物3D打印活性墨水可以和大部分水溶性生长因子(重组人表皮生长因子、细胞因子模拟肽等)或细胞成分(外泌体、细胞囊泡等)进行结合,用于活性成分保护和缓释,有助于增强生物学效应。同时,生物3D打印墨水材料本身均具有良好的生物相容性和保湿性,可以减轻创面炎症反应和瘢痕收缩,在创面治疗和促进组织再生的过程中发挥重要作用。
总之,在临床应用路径选择上,无论是体外培养后移植还是原位打印即时应用,或是与现有技术结合应用,都可以根据具体情况选择最适合的生物3D打印皮肤的临床路径,以实现更好的治疗效果和患者的康复。
3. 生物3D打印皮肤的未来展望
2023年7月首届西湖未来论坛期间,“生物墨水”被美国化学文摘社(CAS)与西湖大学联合评选为“最值得关注的十大生物健康材料”之一,可见其将在未来的生物医药领域发挥巨大潜力。近年来,对生物墨水的性能研究逐渐成为生物3D打印领域的热门分支,其研究进展和成果产出将显著影响生物3D打印器官行业的发展。然而,目前生物墨水的机械性能、细胞兼容性以及促进组织功能性再生的功能仍未达到理想水平,这在很大程度上限制了生物3D打印器官的研究进展[19]。因此,在结构和功能优化的基础上,针对多种临床路径研发特定的皮肤打印相关生物墨水,对未来生物3D打印皮肤的研究具有十分关键的意义。
此外,由于目前还没有出现相对成熟的生物3D打印皮肤产品评价标准,因此其安全性和有效性评价仍然按照组织工程皮肤的评价方法进行。但是,由于生物3D打印皮肤的结构功能多样性以及临床路径多样性,其特点与传统组织工程皮肤完全不同,如何在新的临床路径基础上探讨安全性和有效性评价是接下来的重要议题。例如,在原位光聚合打印的生物3D打印皮肤应用时,我们建议以生物3D打印活性墨水为单位进行安全性评价,这样的评价方法可能更有利于生物3D打印活性墨水的研发和快速转化落地,从而推动生物3D打印技术的快速临床应用。
综上所述,生物墨水作为生物3D打印领域的关键材料,其在机械性能、细胞兼容性和促进组织功能性再生方面仍有较大发展空间。针对多种临床路径研发特定的皮肤打印相关生物墨水具有十分重要的意义,并对未来生物3D打印皮肤的研究具有关键意义。此外,针对生物3D打印皮肤的安全性和有效性评价也需要根据其特殊性质进行调整,以适应其在临床应用中的需求。随着对生物墨水和生物3D打印皮肤的深入研究,相信这一领域将迎来更多突破和创新,推动生物3D打印技术向着更广泛的临床应用迈进。
【参考文献】
[1] Park W, Gao G, Cho DW. Tissue-Specific Decellularized Extracellular Matrix Bioinks for Musculoskeletal Tissue Regeneration and Modeling Using 3D Bioprinting Technology. Int J Mol Sci. 2021 Jul 22;22(15):7837.
[2] Arampatzis AS, Kontogiannopoulos KN, Theodoridis K, et al. Electrospun wound dressings containing bioactive natural products: physico-chemical characterization and biological assessment. Biomater Res. 2021 Jul 16;25(1):23.
[3] Sabzevari A, Rayat Pisheh H, Ansari M, et al. Progress in bioprinting technology for tissue regeneration. J Artif Organs. 2023 Dec;26(4):255-274.
[4] Cha M, Jin YZ, Park JW, et al. Three-dimensional printed polylactic acid scaffold integrated with BMP-2 laden hydrogel for precise bone regeneration. Biomater Res. 2021 Oct 27;25(1):35.
[5] Li Z, Huang S, Fu X. 3D bioprinting skin (3D bioprinting for reconstructive surgery, techniques and applications), Woodhead Publishing, Elsvier, 2018.
[6] Atala A. Thirty Years of Tissue Engineering. Tissue Eng Part A. 2023 Nov 11.
[7] Ng WL, Qi JTZ, Yeong WY, et al. Proof-of-concept: 3D bioprinting of pigmented human skin constructs. Biofabrication. 2018 Jan 23;10(2):025005.
[8] Jorgensen AM, Gorkun A, Mahajan N, et al. Multicellular bioprinted skin facilitates human-like skin architecture in vivo. Sci Transl Med. 2023 Oct 4;15(716):eadf7547.
[9] Abaci HE, Coffman A, Doucet Y, et al. Tissue engineering of human hair follicles using a biomimetic developmental approach. Nat Commun. 2018 Dec 13;9(1):5301.
[10] Huang S, Yao B, Xie J, et al. 3D bioprinted extracellular matrix mimics facilitate directed differentiation of epithelial progenitors for sweat gland regeneration. Acta Biomater. 2016 Mar 1;32:170-177.
[11] Zhang Y, Enhejirigala, Li Z, et al. The role of CTHRC1 in hair follicle regenerative capacity restored by plantar dermis homogenate. Biochem Biophys Res Commun. 2021 Sep 24;571:14-19.
[12] Bin Y, Dongzhen Z, Xiaoli C, et al. Modeling human hypertrophic scars with 3D preformed cellular aggregates bioprinting. Bioact Mater. 2021 Sep 8;10:247-254.
[13] Motter Catarino C, Cigaran Schuck D, Dechiario L, et al. Incorporation of hair follicles in 3D bioprinted models of human skin. Sci Adv. 2023 Oct 13;9(41):eadg0297.
[14] Wu Y, Ravnic DJ, Ozbolat IT. Intraoperative Bioprinting: Repairing Tissues and Organs in a Surgical Setting. Trends Biotechnol. 2020 Jun;38(6):594-605.
[15] Albanna M, Binder KW, Murphy SV, et al. In Situ Bioprinting of Autologous Skin Cells Accelerates Wound Healing of Extensive Excisional Full-Thickness Wounds. Sci Rep. 2019 Feb 12;9(1):1856.
[16] Pagan E, Stefanek E, Seyfoori A, et al. A handheld bioprinter for multi-material printing of complex constructs. Biofabrication. 2023 May 2;15(3).
[17]宋薇, 李曌, 朱世钧等. 含人脐血来源富血小板血浆的三维生物打印墨水在裸鼠全层皮肤缺损创面治疗中的应用效果. 中华烧伤与创面修复杂志, 2022, 38(10): 905-913.
[18] Zhao M, Wang J, Zhang J, et al. Functionalizing multi-component bioink with platelet-rich plasma for customized in-situ bilayer bioprinting for wound healing. Mater Today Bio. 2022 Jun 24;16:100334.
[19] Kang MS, Jang J, Jo HJ, et al. Advances and Innovations of 3D Bioprinting Skin. Biomolecules. 2022 Dec 27;13(1):55.
作者简介

黄沙教授,中国人民解放军总医院医学创新研究部创伤修复与组织再生研究中心,损伤器官重构与再造重点实验室副主任,“卓青”人才、科技领军人才、基础加强重大项目首席科学家。中国生物材料学会临床试验研究分会副主任委员,中国研究型医院学会生物材料临床应用分会副主任委员,中国老年医学会烧创伤学分会常务委员。主编出版国内首本生物3D打印学术专著《生物3D打印与再生医学》,获政府出版奖。获中国生物材料学会科学技术进步奖(一等)、王正国创伤医学奖、Bioactive Materials Innovation Award、科技创新先锋个人等荣誉称号,完成生物墨水成果转化。主持国家自然科学基金及国家重点研发计划等16项。
实现皮肤的完美再生一直是现代医学追求的目标。然而,传统的自体皮移植由于供体来源的限制、供体部位的缺陷、免疫排斥和感染等因素的存在,其应用范围受到一定程度的限制[1]。此外,现有的创面敷料只适用于浅表创面的促愈治疗,无法处理大面积和深部创面。因此,从20世纪80年代开始,基于组织工程的皮肤替代物构建引起了广泛关注并迅速发展。然而,由于技术的局限性,目前的组织工程皮肤在结构和功能上相对简单,难以满足临床实际需求[2]。
进入21世纪,随着生物3D打印技术的兴起,为皮肤替代物的研究带来了新的机遇。生物3D打印技术是以计算机三维模型为模板,装配特制“生物墨水”,最终制造出人造器官和生物医学产品的新科技手段。从2007年的概念兴起到现在,这项技术经历了飞速发展,目前已成为了最热门、最具有应用前景的组织工程技术,促使再生医学研究与转化提升到了一个新高度[3]。
相较于传统的组织工程技术,生物3D打印技术具有按需构建特殊形状和复杂结构的皮肤替代物的能力,并且具有更高的精度[4]。近年来,生物3D打印皮肤相关的生物墨水基础生物材料的开发、以及结构功能的整合研究等均取得了迅速进展,逐步实现了皮肤结构和功能的多样性构建。同时,基于不同的生物3D打印皮肤构建策略,衍生出了多种生物3D打印皮肤替代物的临床使用场景和路径,以满足不同的创面治疗需求。这意味着生物3D打印皮肤替代物可以更好地适应不同类型的创面,为患者带来更加个性化、精准的治疗方案。本文旨在对生物3D打印皮肤的最新研究进展进行简要概述,并探讨其在临床应用中的多重潜在路径,以期为未来的研究和临床应用提供明确定位和发展方向。
1. 生物3D打印皮肤的研究进展
由于皮肤具有简单层状平面的生理结构,因此在生物3D打印研究中具有天然优势[5]。经过十多年的研发,国内外多个研究团队已经发表了生物3D打印皮肤的研究进展。生物3D打印皮肤已经在许多方面超越了传统组织工程皮肤,其结构和功能模拟更加快速且全面,应用路径、应用场景和应用方向呈现多样化[6]。
在打印结构方面,生物3D打印皮肤不仅可以包含传统组织工程皮肤的层状(表皮层、真皮层和皮下组织层)结构,而且可以将具有特殊功能的细胞(如黑素细胞、朗汉细胞等)和结构模块精准嵌入皮肤中,从而实现皮肤的全结构再造。Ng等[7]报道了含有表皮细胞、黑素细胞和成纤维细胞的仿生3D打印皮肤模型,该皮肤的色素沉着较普通组织工程皮肤更能模拟人体正常皮肤的色素水平(如图1A)。Atala等[8]报道了含有6种皮肤相关细胞和三层结构的生物3D打印皮肤,在体外培养56天达到成熟后移植入裸鼠背部创面,实现创面的快速愈合(如图1B)。

图1.生物3D打印皮肤的结构设计(A)含有黑素细胞、表皮细胞和真皮成纤维细胞的生物3D打印双层皮肤[7];(B)含有六种皮肤相关细胞的生物3D打印三层结构皮肤的设计和体外培养52天后的形态[8]。
在功能重建方面,生物3D打印皮肤不仅可以通过装载入打印组织的特殊功能细胞和附属器实现特定功能,而且还可以根据植入后血管神经长入的需求,在特定部位加入血管、神经的种子细胞或活性诱导因子,可有效增强打印皮肤的成活率。Abaci等[9]报道了含有毛囊仿生结构的生物3D打印皮肤,且在裸鼠背部创面移植后长出毛发。Huang等[10]报道了生物3D打印皮肤中诱导间充质干细胞向汗腺分化,并将该打印皮肤用于小鼠足掌烧伤创面治疗并促进该部位汗腺功能重建。
另外,皮肤附属器和皮肤疾病的体外研究模型构建也取得了很多进展。Yao B.等[12]还将人源性瘢痕细胞和瘢痕细胞外基质混入生物墨水,打印出的组织体外培养后移植入裸鼠背部,形成了表征稳定的人源性瘢痕类器官,可用于瘢痕形成机制研究和药物筛选(如图2A);Zhang Y.等[11]利用悬滴培养法构建了毛囊细胞球,将该细胞球种植于前期制备成熟的含有诱导汗腺组织的生物3D打印皮肤内,构建出同时含有汗腺和毛囊的生物3D打印皮肤,可以用于皮肤和汗腺相互作用机制的基础研究(如图2B)。

图2. 生物3D打印皮肤瘢痕和皮肤附属器模型(A)生物3D打印人源性皮肤瘢痕模型用于瘢痕治疗药物筛选;(B)生物3D打印含汗腺和毛囊的皮肤模型用于汗腺和毛囊相互作用研究。
2. 生物3D打印皮肤的临床应用路径
随着技术的不断进步和临床实践的积累,生物3D打印皮肤在临床应用中的潜力逐渐展现。相比传统组织工程皮肤,生物3D打印皮肤具有更多可选择的临床应用路径。
首先,绝大部分生物3D打印皮肤可以使用与传统组织工程皮肤相同的临床路径,即将生物3D打印皮肤在体外培养至成熟状态,然后再移植到患者的创面上[8,13]。这种方法可以确保打印皮肤具备足够的结构完整性,同时也提供了更多的时间进行细胞和组织的诱导培养和功能成熟。这种传统的应用路径在一些复杂创面重建术中已经得到应用,但是由于体外诱导培养需要较高的实验条件,培养时间一般较长,而且存在打印结构降解和污染的风险,所以流程复杂性可能会影响该临床路径的广泛应用。
近年来,随着光聚合材料的快速推广,临床即用型生物3D打印技术也快速在皮肤再生领域得到了应用[14]。Albanna等将三维扫描和在创面原位打印并光聚合构建双层皮肤的方法在实验动物模型中进行了全流程模拟,并取得了良好的创面治疗效果[15](如图3A)。这个临床路径应用了目前最先进的三维扫描仪、光聚合生物材料(GelMA、HAMA等改性高分子材料和LAP等光引发剂)以及手持式生物3D打印机[16](如图3B),脱离了实验室环境,达到了床旁快速的皮肤3D打印和即时使用的效果,避免了传统路径中体外培养过程中的变形和污染风险。

图3.生物3D打印皮肤的床旁打印和使用路径(A)三维扫描和在创面原位打印构建双层皮肤的方法用于创面急救与治疗;(B)手持式生物3D打印构建含有表皮细胞和真皮成纤维细胞的皮肤模型。
除此之外,生物3D打印还可以与现有治疗技术结合,为患者提供更为精确和定制化的解决方案。自体采集的富血小板血浆(PRP)含有创面愈合所需的多种生长因子,因此常用于创面治疗,传统的用法是将其与氯化钙或者凝血酶混合,在创面形成凝胶并激活血小板释放生长因子,但是这种应用方法的血小板用量较大,并且由于血小板没有保护在创面释放后生物活性衰减迅速。针对血小板在创面应用中存在的这些问题,宋薇等将PRP与生物3D打印技术结合,用于小鼠创面模型的治疗,使得创面血管化显著增强而且创面愈合加速的效果[17]。Zhao M等还将创面三维扫描和打印路径设计等工程技术与含PRP的生物3D打印结合用于创面治疗[18]。除了可以结合PRP以外,生物3D打印活性墨水可以和大部分水溶性生长因子(重组人表皮生长因子、细胞因子模拟肽等)或细胞成分(外泌体、细胞囊泡等)进行结合,用于活性成分保护和缓释,有助于增强生物学效应。同时,生物3D打印墨水材料本身均具有良好的生物相容性和保湿性,可以减轻创面炎症反应和瘢痕收缩,在创面治疗和促进组织再生的过程中发挥重要作用。

图4.生物3D打印与现有创面治疗技术结合的临床路径(A)生物3D打印结合富血小板血浆血浆(PRP)用于创面治疗;(B)生物3D打印结合PRP、三维扫描和路径设计等工程技术用于创面治疗。
总之,在临床应用路径选择上,无论是体外培养后移植还是原位打印即时应用,或是与现有技术结合应用,都可以根据具体情况选择最适合的生物3D打印皮肤的临床路径,以实现更好的治疗效果和患者的康复。
3. 生物3D打印皮肤的未来展望
2023年7月首届西湖未来论坛期间,“生物墨水”被美国化学文摘社(CAS)与西湖大学联合评选为“最值得关注的十大生物健康材料”之一,可见其将在未来的生物医药领域发挥巨大潜力。近年来,对生物墨水的性能研究逐渐成为生物3D打印领域的热门分支,其研究进展和成果产出将显著影响生物3D打印器官行业的发展。然而,目前生物墨水的机械性能、细胞兼容性以及促进组织功能性再生的功能仍未达到理想水平,这在很大程度上限制了生物3D打印器官的研究进展[19]。因此,在结构和功能优化的基础上,针对多种临床路径研发特定的皮肤打印相关生物墨水,对未来生物3D打印皮肤的研究具有十分关键的意义。
此外,由于目前还没有出现相对成熟的生物3D打印皮肤产品评价标准,因此其安全性和有效性评价仍然按照组织工程皮肤的评价方法进行。但是,由于生物3D打印皮肤的结构功能多样性以及临床路径多样性,其特点与传统组织工程皮肤完全不同,如何在新的临床路径基础上探讨安全性和有效性评价是接下来的重要议题。例如,在原位光聚合打印的生物3D打印皮肤应用时,我们建议以生物3D打印活性墨水为单位进行安全性评价,这样的评价方法可能更有利于生物3D打印活性墨水的研发和快速转化落地,从而推动生物3D打印技术的快速临床应用。
综上所述,生物墨水作为生物3D打印领域的关键材料,其在机械性能、细胞兼容性和促进组织功能性再生方面仍有较大发展空间。针对多种临床路径研发特定的皮肤打印相关生物墨水具有十分重要的意义,并对未来生物3D打印皮肤的研究具有关键意义。此外,针对生物3D打印皮肤的安全性和有效性评价也需要根据其特殊性质进行调整,以适应其在临床应用中的需求。随着对生物墨水和生物3D打印皮肤的深入研究,相信这一领域将迎来更多突破和创新,推动生物3D打印技术向着更广泛的临床应用迈进。
【参考文献】
[1] Park W, Gao G, Cho DW. Tissue-Specific Decellularized Extracellular Matrix Bioinks for Musculoskeletal Tissue Regeneration and Modeling Using 3D Bioprinting Technology. Int J Mol Sci. 2021 Jul 22;22(15):7837.
[2] Arampatzis AS, Kontogiannopoulos KN, Theodoridis K, et al. Electrospun wound dressings containing bioactive natural products: physico-chemical characterization and biological assessment. Biomater Res. 2021 Jul 16;25(1):23.
[3] Sabzevari A, Rayat Pisheh H, Ansari M, et al. Progress in bioprinting technology for tissue regeneration. J Artif Organs. 2023 Dec;26(4):255-274.
[4] Cha M, Jin YZ, Park JW, et al. Three-dimensional printed polylactic acid scaffold integrated with BMP-2 laden hydrogel for precise bone regeneration. Biomater Res. 2021 Oct 27;25(1):35.
[5] Li Z, Huang S, Fu X. 3D bioprinting skin (3D bioprinting for reconstructive surgery, techniques and applications), Woodhead Publishing, Elsvier, 2018.
[6] Atala A. Thirty Years of Tissue Engineering. Tissue Eng Part A. 2023 Nov 11.
[7] Ng WL, Qi JTZ, Yeong WY, et al. Proof-of-concept: 3D bioprinting of pigmented human skin constructs. Biofabrication. 2018 Jan 23;10(2):025005.
[8] Jorgensen AM, Gorkun A, Mahajan N, et al. Multicellular bioprinted skin facilitates human-like skin architecture in vivo. Sci Transl Med. 2023 Oct 4;15(716):eadf7547.
[9] Abaci HE, Coffman A, Doucet Y, et al. Tissue engineering of human hair follicles using a biomimetic developmental approach. Nat Commun. 2018 Dec 13;9(1):5301.
[10] Huang S, Yao B, Xie J, et al. 3D bioprinted extracellular matrix mimics facilitate directed differentiation of epithelial progenitors for sweat gland regeneration. Acta Biomater. 2016 Mar 1;32:170-177.
[11] Zhang Y, Enhejirigala, Li Z, et al. The role of CTHRC1 in hair follicle regenerative capacity restored by plantar dermis homogenate. Biochem Biophys Res Commun. 2021 Sep 24;571:14-19.
[12] Bin Y, Dongzhen Z, Xiaoli C, et al. Modeling human hypertrophic scars with 3D preformed cellular aggregates bioprinting. Bioact Mater. 2021 Sep 8;10:247-254.
[13] Motter Catarino C, Cigaran Schuck D, Dechiario L, et al. Incorporation of hair follicles in 3D bioprinted models of human skin. Sci Adv. 2023 Oct 13;9(41):eadg0297.
[14] Wu Y, Ravnic DJ, Ozbolat IT. Intraoperative Bioprinting: Repairing Tissues and Organs in a Surgical Setting. Trends Biotechnol. 2020 Jun;38(6):594-605.
[15] Albanna M, Binder KW, Murphy SV, et al. In Situ Bioprinting of Autologous Skin Cells Accelerates Wound Healing of Extensive Excisional Full-Thickness Wounds. Sci Rep. 2019 Feb 12;9(1):1856.
[16] Pagan E, Stefanek E, Seyfoori A, et al. A handheld bioprinter for multi-material printing of complex constructs. Biofabrication. 2023 May 2;15(3).
[17]宋薇, 李曌, 朱世钧等. 含人脐血来源富血小板血浆的三维生物打印墨水在裸鼠全层皮肤缺损创面治疗中的应用效果. 中华烧伤与创面修复杂志, 2022, 38(10): 905-913.
[18] Zhao M, Wang J, Zhang J, et al. Functionalizing multi-component bioink with platelet-rich plasma for customized in-situ bilayer bioprinting for wound healing. Mater Today Bio. 2022 Jun 24;16:100334.
[19] Kang MS, Jang J, Jo HJ, et al. Advances and Innovations of 3D Bioprinting Skin. Biomolecules. 2022 Dec 27;13(1):55.
作者简介

黄沙教授,中国人民解放军总医院医学创新研究部创伤修复与组织再生研究中心,损伤器官重构与再造重点实验室副主任,“卓青”人才、科技领军人才、基础加强重大项目首席科学家。中国生物材料学会临床试验研究分会副主任委员,中国研究型医院学会生物材料临床应用分会副主任委员,中国老年医学会烧创伤学分会常务委员。主编出版国内首本生物3D打印学术专著《生物3D打印与再生医学》,获政府出版奖。获中国生物材料学会科学技术进步奖(一等)、王正国创伤医学奖、Bioactive Materials Innovation Award、科技创新先锋个人等荣誉称号,完成生物墨水成果转化。主持国家自然科学基金及国家重点研发计划等16项。
(责任编辑:admin)
最新内容
热点内容


 重磅:AI开源大风刮到自动
重磅:AI开源大风刮到自动 增材制造助力半导体产业:
增材制造助力半导体产业: 非粉末床金属增材制造综述
非粉末床金属增材制造综述 生物3D打印载细胞微球治疗
生物3D打印载细胞微球治疗 突破:特种钢细粉收得率达
突破:特种钢细粉收得率达 赋能绿色能源装备长效运行
赋能绿色能源装备长效运行 选区激光熔化增材
选区激光熔化增材 大型聚合物3D打印
大型聚合物3D打印 6K Additive最新
6K Additive最新 如何打造增材制造
如何打造增材制造 从实验室走向生产
从实验室走向生产 3D打印在口腔修复
3D打印在口腔修复

