《Bioactive Materials》:3D打印支架功能再革新,为促进骨再生提供微环境(2)
时间:2023-04-27 13:07 来源:EngineeringForLife 作者:admin 阅读:次
6. 3D免疫支架的体内骨再生
在骨缺损部位,损伤微环境生态位涉及各种细胞和因素(图6a)。创建直径为5 mm的全层骨缺损,并将3D支架植入缺损中(图6b)。4周后,收获颅骨碎片以分析骨形成(图6c-d)。如图6e所示,显微CT图像表明,植入3D支架的缺损部位内的新骨形成更显着,空对照的新骨形成最少。对于用3D材料功能化的三种类型的2D支架,沿着缺陷边缘形成了小规模的完整骨块(图6e)。此外,免疫调节细胞因子负荷可进一步加速骨形成(图6f-h)。主要器官的HE染色表明,本研究中使用的3D支架在体内条件下具有生物相容性,与体外细胞评估一致(图6i)。
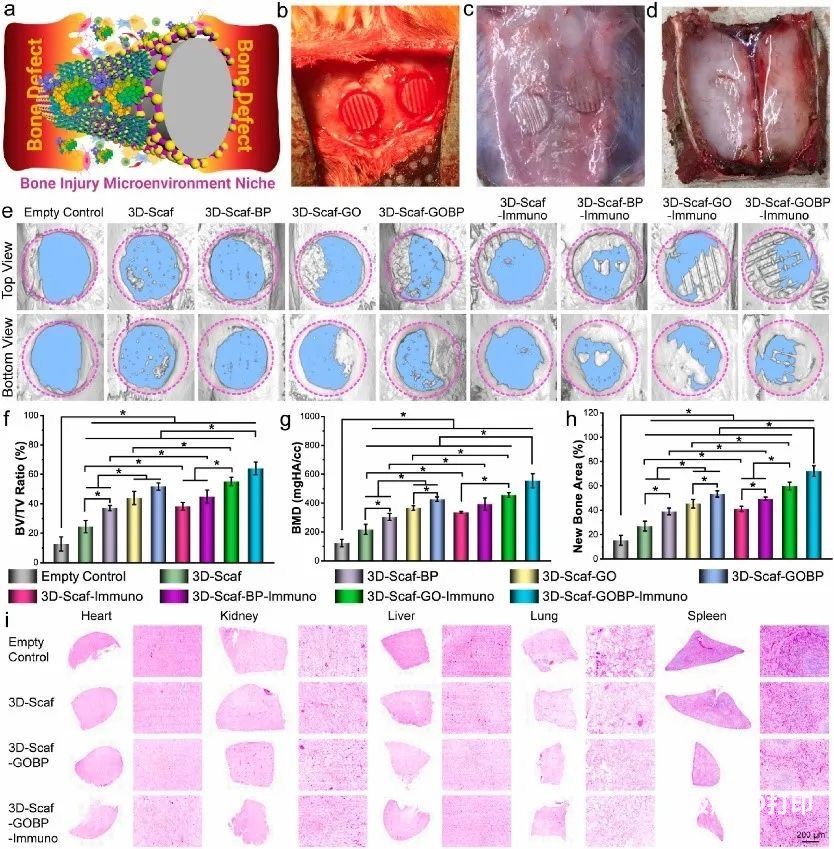
图6 免疫功能支架的体内骨形成
7. 体内新生血管形成和成骨
为了评估在颅骨缺损部位植入的3D支架的骨修复,收获的骨组织在嵌入石蜡后进行脱钙和切片。图7a-c显示,3D支架可以桥接骨缺损,并为细胞在骨缺损区域进行和分配提供优异的组织导电性。CD31和ALP表明支架植入促进了细胞募集和组织形成(图7d),荧光强度的定量结果也与之相符(图7e-f)。
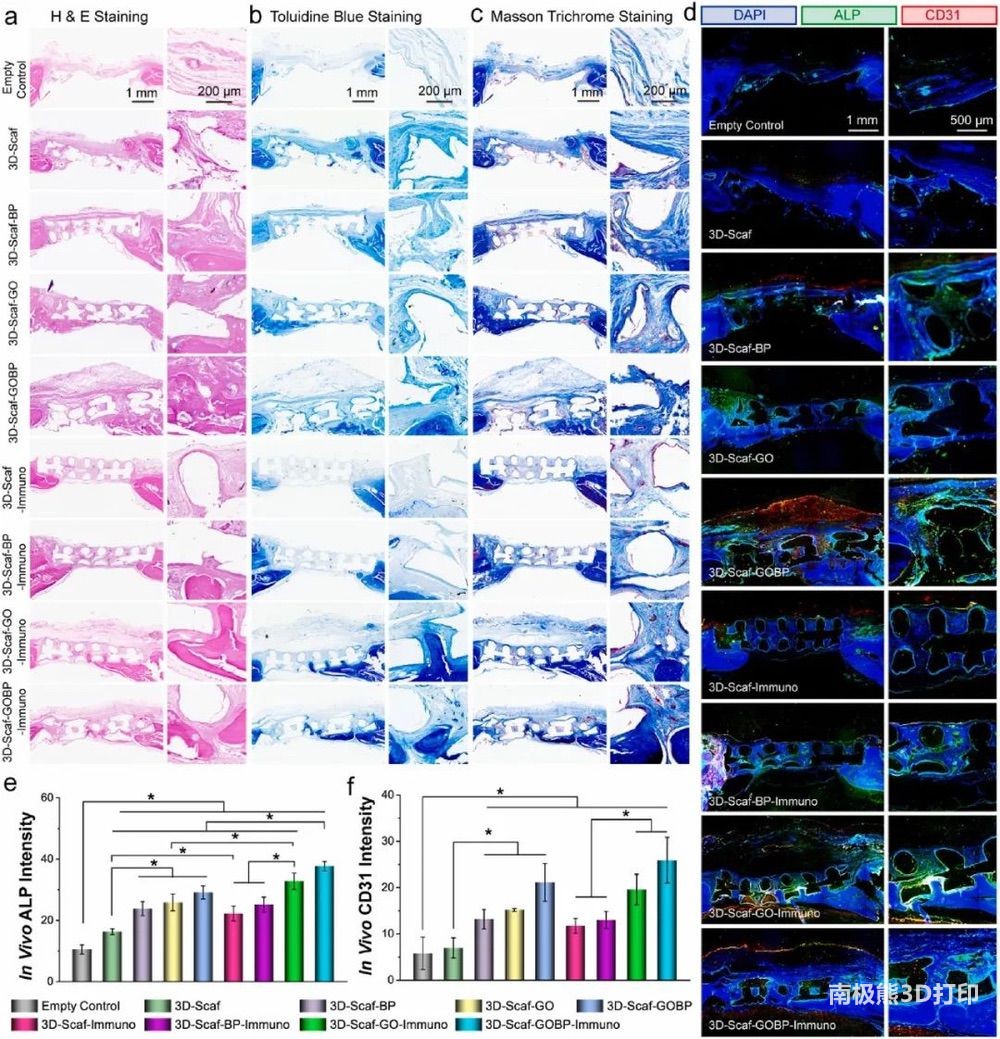
图7 大鼠颅骨缺损模型中的免疫组织学分析和体内新生血管和成骨
8. 体内M2巨噬细胞表型调节
为测定骨缺损体内巨噬细胞募集和M2表型极化,对颅骨进行CD68和CD206免疫荧光双染色。对于3D-Scaf-GOBP,在组织内观察到CD68和CD206荧光的广泛分布,表明异质纳米结构的功能可以增强巨噬细胞对3D支架的募集(图8a),定量计算与荧光图像一致(图8b-c)。CD206荧光的体内分布表明了偏振M2巨噬细胞的位置,对于这些3D支架来说是独一无二的(图8a)。观察到有效的CD206荧光包围植入的3D支架脊,表征了CD206荧光强度与到支架脊表面的距离的关系(图8d)。
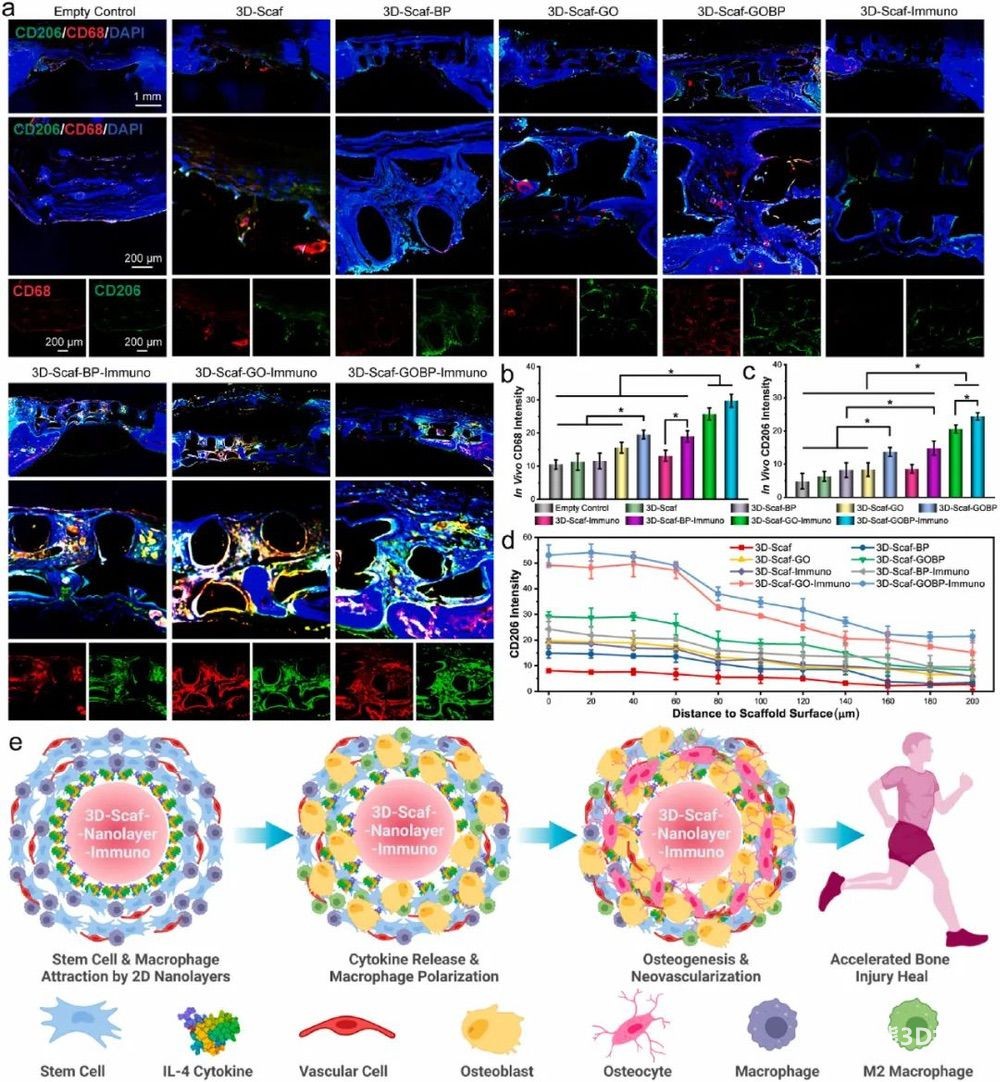
图8 体内巨噬细胞表型表征
综上,本文通过结合3D异质纳米结构和免疫调节IL-2细胞因子,成功构建了免疫功能化的3D支架,并通过创建促愈合的免疫微环境优化了体内骨损伤修复。体外测试表明,由GO和BP纳米片组成的二维异质纳米结构可以提高细胞粘附,磷酸根离子的持续释放刺激细胞增殖和成骨。二维异质纳米层还增加了免疫调节IL-2细胞因子的负载量,并调节巨噬细胞极化为M2表型,以构建有利于愈合的免疫微环境,以改善血管生成和成骨。体内植入结果表明,免疫功能化的3D支架桥接损伤缺陷,增强细胞募集,并通过磷酸盐的持续释放刺激体内新生血管和成骨作用。负载的IL-2细胞因子进一步促进了巨噬细胞极化为M3表型,这可能有助于建立促进愈合的微环境以加速骨损伤恢复。因此,具有免疫调节细胞因子二次加载的2D GOBP异质纳米结构的3D支架的免疫功能化可以为3D打印的支架提供支持快速骨损伤恢复的有希望的策略。
文章来源:https://doi.org/10.1016/j.bioactmat.2023.03.021
(责任编辑:admin)
相关内容
最新内容
热点内容


 梁柏涛:美国参议院这一票
梁柏涛:美国参议院这一票 美国俄亥俄州宣布拨款6200
美国俄亥俄州宣布拨款6200 Schunk集团全资收购ESK-SI
Schunk集团全资收购ESK-SI 美国空军利用拓竹3D打印机
美国空军利用拓竹3D打印机 3D Systems推出集成式数字
3D Systems推出集成式数字 Aker Solutions设立新3D打
Aker Solutions设立新3D打 GoEngineer通过收
GoEngineer通过收 3D食品打印:烹
3D食品打印:烹 卡内基梅隆研究人
卡内基梅隆研究人 Align Technology
Align Technology AM Craft在种子轮
AM Craft在种子轮 Aerojet拿下五角
Aerojet拿下五角

