通过水相嵌入式生物打印的界面凝聚实现相互连接管状通道自由形式3D网络进行原位内皮化
时间:2022-12-15 14:36 来源:EngineeringForLife 作者:admin 阅读:次
2022年11月30日,来自深圳大学孔湉湉副教授、刘洲副研究员及其团队在《Advanced Materials》杂志发表题为“In-situ endothelialization of freeform 3D network of interconnected tubular channels via interfacial coacervation by aqueous-in-aqueous embedded bioprinting”的研究论文,提出了通过ATPS嵌入式生物打印通过界面凝聚在相互连接的细胞衬里管状通道的自由形态3D血管网络的体外生产。新制备的ATPS的界面凝聚不仅保持了水-水结构,而且可以作为细胞附着和生长的丝状支架。
1. 一步法完成任意设计的空心通道互联3D网络和原位细胞播种
为了在原位细胞播种的情况下自由构建微通道的血管网络,研究者设计了一种在界面处产生凝聚复合物的双水相体系,用于细胞附着和生长。墨水相由右旋糖酐(DEX)、聚赖氨酸(PLL)和活细胞组成,而基质相是oxBC纳米纤维和聚乙二醇(PEG)的水溶液混合物。为了形成凝聚复合物,选择了弱聚阳离子【因为强聚阳离子具有细胞毒性,如聚乙烯亚胺(PEI)、聚丙烯胺盐酸盐(PAH)、聚二烯丙基二甲基氯化铵(PDDA)和氯壳聚糖(HACC)】,聚赖氨酸(PLL)作为携带细胞的墨水相。同时,由于具有羧基的oxBC纳米纤维可以为所得到的凝聚复合物提供足够的机械支撑和丝状形态,因此被用作聚阴离子。PLL和oxBC都是水解和酶降解的聚电解质。因此,当油墨相被挤出到基体中时,油墨中的PLL与基体中的oxBC瞬间在水/水界面处形成凝聚络合物;oxBC的电离羧基和PLL的质子化氨基之间的静电络合产生了丝状膜,作为细胞粘附的支架。为了在基质中保持沉积油墨的任意结构,两种水相都被调整为剪切减薄和屈服应力液体。当oxBC浓度为0.5 ~ 3 wt%时,基体的屈服应力约为1 Pa; 而油墨的压力约为5mpa。因此,通过将PLL/oxBC的细胞负载ATPS与嵌入式生物打印相结合,可以一步完成任意设计的空心通道互联3D网络和原位细胞播种。(图1)
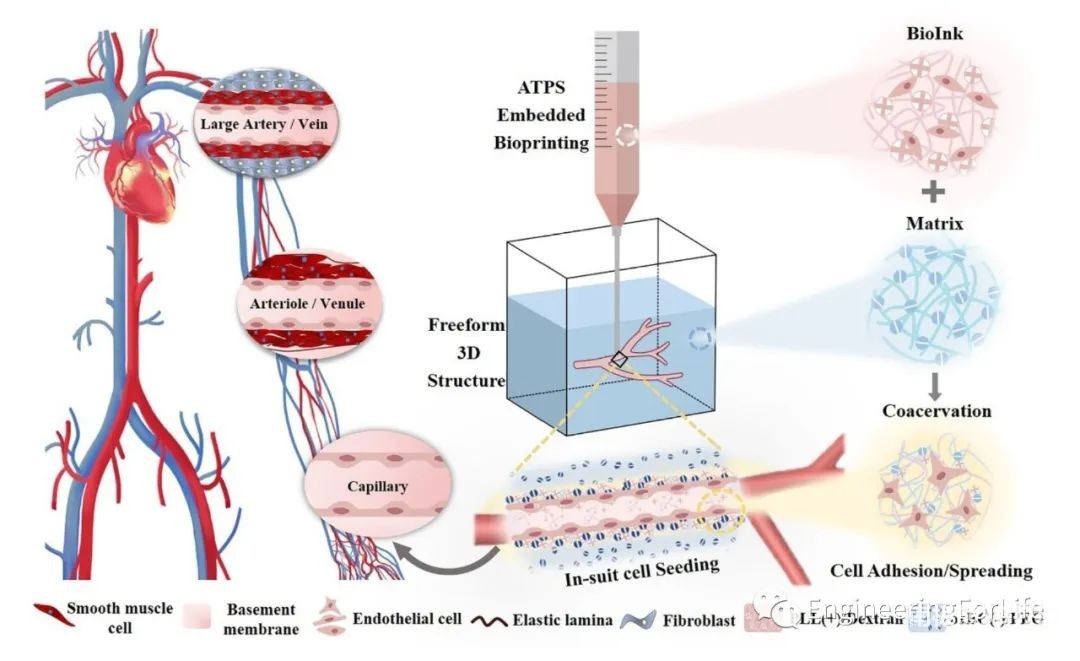
图1 研究重点和工作流程的示意图
2. oxBC和PLL在水/水界面的复合凝聚是原位形成膜支架和原位细胞播种的关键
PLL分子与oxBC纳米纤维络合形成的膜质支架呈丝状,适合细胞粘附和扩散。为了优化膜质支架的理化性能,进一步研究了膜质支架的界面凝聚过程。一旦墨水相被挤压到基质相,PLL分子和oxBC纳米纤维在界面上的相互扩散就由浓度梯度决定。由于PLL分子的尺寸比oxBC纳米纤维小得多,因此PLL分子的扩散主导了复合凝聚过程。因此,PLL的初始浓度较高会导致更厚的凝聚复合体层。事实上,凝聚PLL/oxBC层的平衡厚度随PLL浓度线性增加。相反,当oxBC的浓度从0.25 wt%增加到3 wt%时,聚结络合物层变薄。这可能是由于在界面另一侧有更多的oxBC纳米纤维被PLL分子凝聚,形成了网络更密集的凝聚复合体。密集的网络抑制了PLL的后续扩散,呈现出较薄的凝聚复合物层。oxBC浓度越高,对PLL扩散的抑制作用越明显。当PLL墨水在oxBC介质中转换时,管状结构立即出现。PLL浓度越高,oxBC浓度越低,得到的管状结构越厚。管状结构的渗透性主要由oxBC浓度决定。由于纳米纤维的密集网络,PLL/oxBC凝聚配合物的管状结构具有101-102 kPa的弹性模量,与典型的水凝胶相似,提供了结构稳定性和适合在水浴中生长的支持结构。膜支架的渗透性测试进一步支持了PLL扩散为主的过程。我们发现,粒径大于500kda的分子很难在凝聚凝胶膜上扩散。因此,再次证实了界面凝聚主要是由PLL扩散驱动的,并在PLL分子耗尽时终止。因此,通过调节PLL和oxBC的浓度,PLL/oxBC凝聚配合物可以形成稳健的管状结构。(图2)
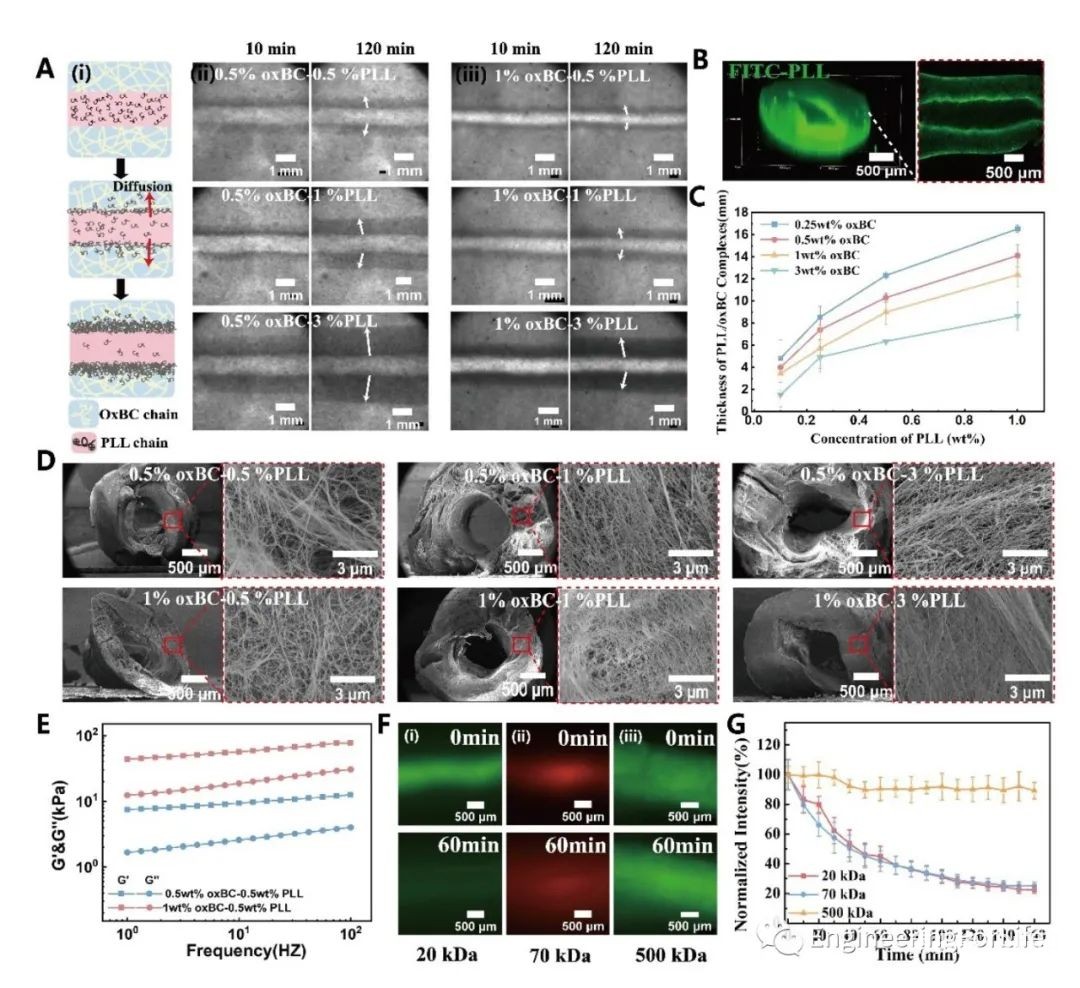
图2 ATPS界面凝聚配合物的形成机理及理化性质
3. 形成可变尺寸和自由结构相互连接的可灌注微通道的三维网络
生物打印机可以实现任意的3D结构。为了确保墨水中细胞的活力,该研究测试了施加压力和渗透压对细胞活力的影响。发现渗透压小于30 mOsm·kg-1和施加压力在100 kPa以内对细胞活力的影响可以忽略不计。随后,通过改变打印机头的大小,应用不同的压力和平移速度进行挤压,测量挤压螺纹的直径。例如,当P = 66.192 kPa (9.6 PSI), d =100 μm时,随着平移速度从1.67 mm·s-1到25 mm·s-1,打印丝的直径可以从1800 μm无缝变化到200 μm。因此,可以通过调节平移速度和施加压力来控制挤压后可灌注微通道的尺寸。因此,使用细胞负载墨水创建并在水环境中保存良好的具有相互连接的空心腔的分支网络,其中可灌注的微通道分裂成较小尺寸的子微通道,就像是血管分叉。同样,一系列互联网络的可渗透性可以构建和保留具有矩形金字塔、长方体、螺旋和正多面体等空间结构的微通道。这些中空结构是足够坚固的处理和替代在其他悬浮浴,如细胞培养基。为了优化细胞活力,通常在打印后10分钟将含有细胞的结构从原始的ATPS培养基转移到细胞培养基中。最后,该方法可以用任意设计制造坚固的、细胞负载的、可灌注的互连管腔的血管样网络。(图3)
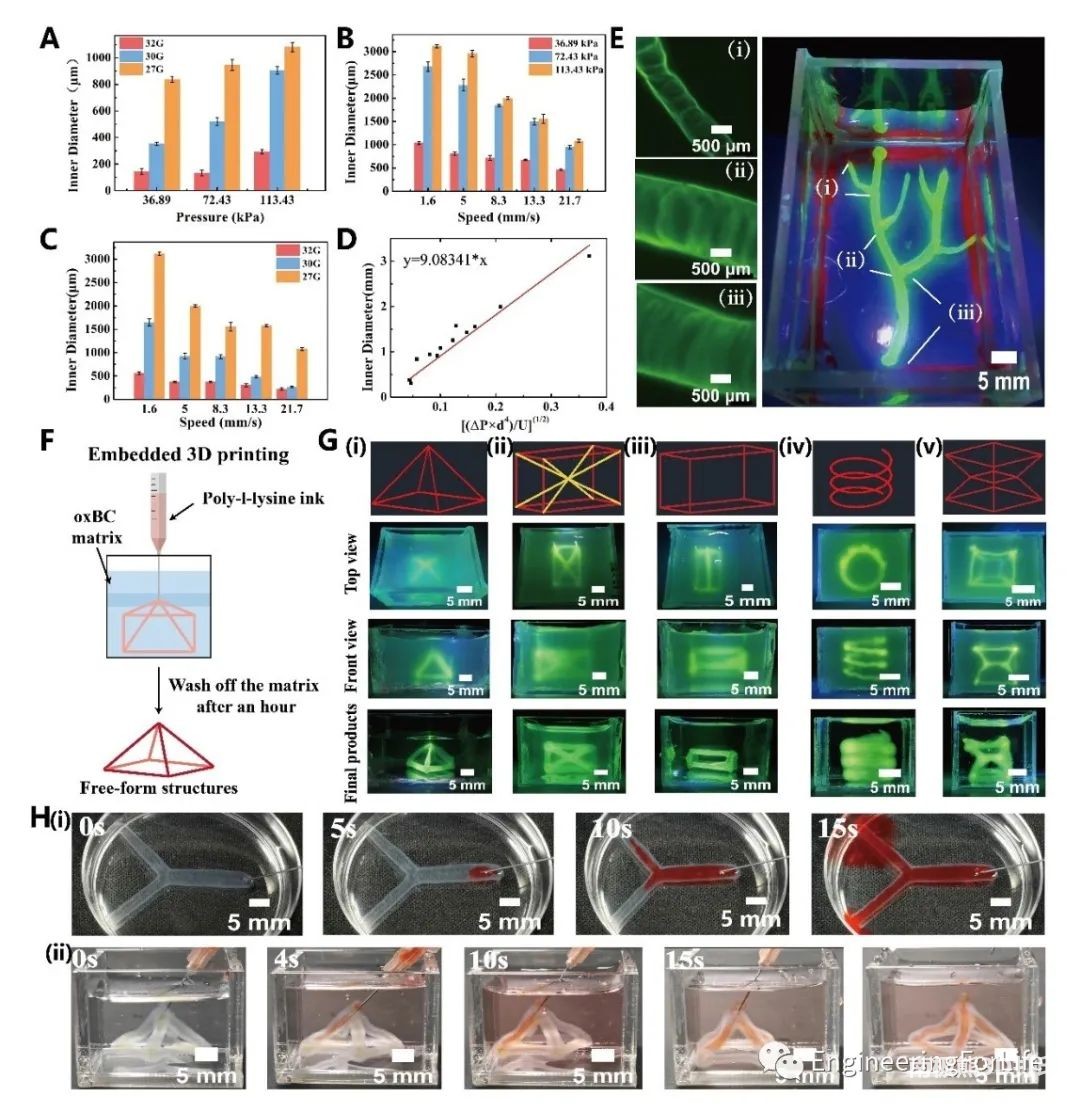
图3 利用PLL/oxBC嵌入式生物打印技术构建可灌注互联腔的任意类血管网络
4. 赋予打印的血管网络生物功能
为了赋予打印的血管网络生物功能,该研究在墨水阶段混合内皮细胞,以促进在打印微通道的管腔上进行原位播种。优化并固定PLL的浓度为0.05 wt%, oxBC相的浓度为0.5 wt%,以同时确保细胞相容性、细胞附着性和印刷适性。打印结构后,将其转移到细胞培养基中进行后续操作。发现PLL/oxBC支架上的种子细胞在第1天开始扩散和增殖,在第3天微通道内表面形成均匀的细胞衬里。PLL/oxBC纳米纤维的静态附着期和丝状网络的结合,有助于将良好的细胞粘附、扩散和增殖。由于墨水阶段的细胞不能在界面上扩散,因此它们附着在界面上的凝聚复合体上。据报道,内皮细胞与支架的静态附着时间对于形成稳定的内皮单层很重要。使用同样的方法,发现很少有内皮细胞可以附着在PLL/藻酸盐支架上,它们的形态保持球形且不增殖。相比之下,PLL/oxBC支架上的种子细胞在7天内增殖175%,表明oxBC的纳米纤维网络,类似于胶原纤维的纳米纤维网络,可以招募内皮细胞并促进细胞生长。培养3天后,内皮细胞粘附增加。提示在存在完整的内皮单层时,细胞间接触良好。平滑肌细胞也有相同表型。为了评估生成的血管网络的功能,研究了其灌注和渗透性特征。结果表明,通过结合细胞负载ATPS墨水和嵌入式生物打印的方法,内皮单层足以模拟血管的屏障功能。因此,该方法为构建内皮管腔生物功能复杂网络提供了一种方便有效的方法。(图4)
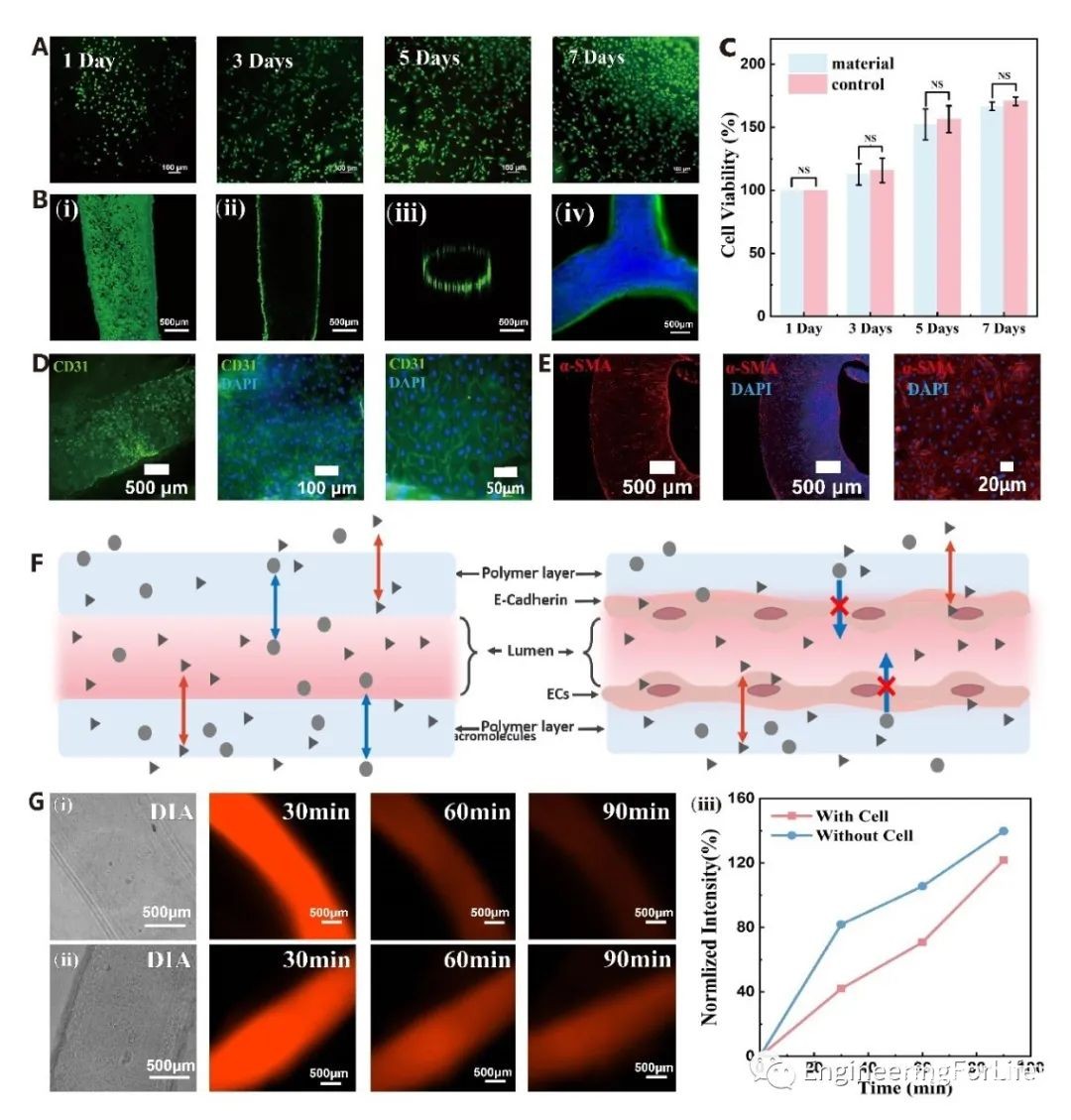
图4 人造维管组织结构物的双重功能
本研究通过在水-水三维嵌入式生物打印中利用界面凝聚策略,生成了具有自由形态结构的可灌注互连管腔的内皮血管网络。这种方法允许保留液中液任意结构,也可以作为坚固的丝状支架,用于在墨水阶段原位播下活细胞。该方法的建立,为未来创建厚的血管化组织、构建基础病理和生理研究的模型、以及药物评估应用方面提供一种新方法、新思路。
文章来源:
https://doi.org/10.1002/adma.202209263
(责任编辑:admin)
相关内容
最新内容
热点内容


 金属3D打印供应商Continuu
金属3D打印供应商Continuu 巴西石油公司启动3D打印实
巴西石油公司启动3D打印实 Snapmaker与Polymaker合作
Snapmaker与Polymaker合作 智利军事理工学院开设3D打
智利军事理工学院开设3D打 AML3D获3000万澳元融资,
AML3D获3000万澳元融资,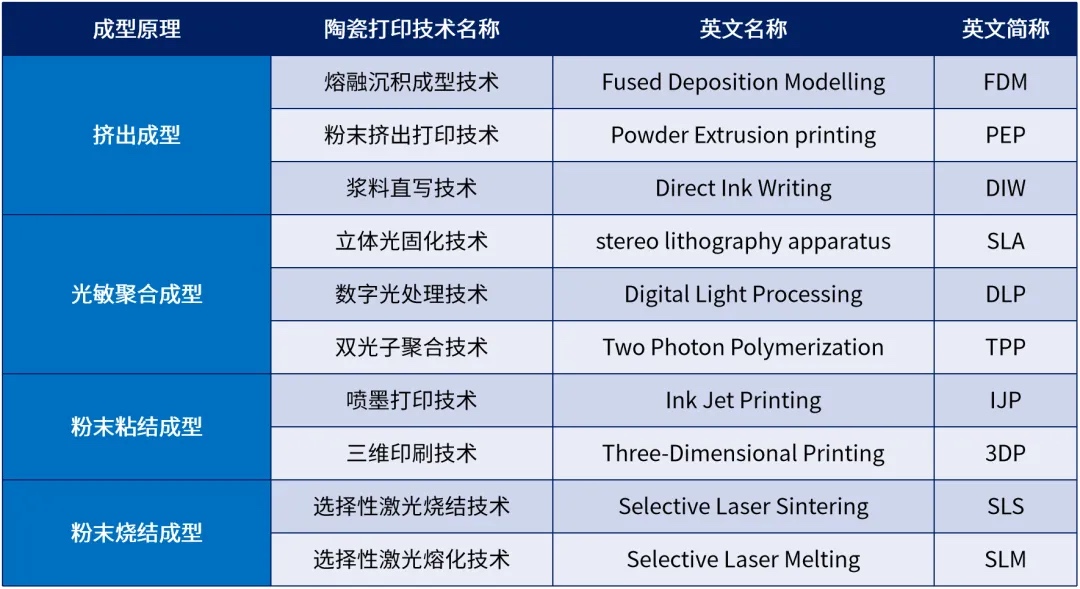 陶瓷3D打印技术特点及PEP
陶瓷3D打印技术特点及PEP 3D食品打印:烹
3D食品打印:烹 卡内基梅隆研究人
卡内基梅隆研究人 Align Technology
Align Technology AM Craft在种子轮
AM Craft在种子轮 Aerojet拿下五角
Aerojet拿下五角 印度初创公司在Gi
印度初创公司在Gi

