上海硅酸盐所在3D打印多功能支架材料研究中取得系列进展
目前临床上对于实体瘤的治疗,通常采用以手术切除为主,化疗、放疗为辅的综合疗法。手术切除大部分骨肿瘤组织之后,在原发灶部位会造成大块组织缺损,超过人体自愈范围,因而需要植入组织工程支架进行诱导修复。同时,由于手术很难完全清除肿瘤细胞,为防止肿瘤复发,临床通常会借助传统化疗和放疗手段,而放疗和化疗对病人会造成很大的毒副作用。为解决该问题,中国科学院上海硅酸盐研究所研究员吴成铁与常江带领的研究团队提出构建兼具肿瘤治疗和组织再生双功能特性的3D打印组织工程支架,近期取得系列进展。
该团队采用3D打印和原位生长相结合的方式,制备了有序大孔结构生物陶瓷的支架,并在支架表面原位生长二硫化钼纳米片(图1),赋予支架在近红外照射下迅速升温的特性。这种制备方式不仅使得二硫化钼纳米片非常稳定地依附在陶瓷支架的外层,而且可以对支架的光热性能和成骨活性进行有效调控。将支架植入肿瘤部位,结合近红外光照射进行治疗,有效抑制了肿瘤的生长,而其他对照组的肿瘤生长不受抑制。同时,体内骨修复实验表明这种复合支架保持了生物陶瓷支架原有的优良成骨活性,且证实短暂的激光照射不会影响长期的新骨再生(图2),在骨肿瘤的治疗与修复中表现出巨大的应用潜力。目前该研究成果被自然出版集团的期刊《亚洲材料》(NPG Asia Materials, AM2016556R)接收,第一作者为在读博士生王小成。
该团队利用多巴胺原位聚合与3D打印生物支架表面矿化的特点,在3D打印的Ca-P-Si生物陶瓷支架表面上诱导出一层自均匀组装的聚多巴胺/Ca-P纳米层(图3),使其兼具光热抗肿瘤的疗效及修复大块骨缺损的能力。诱导后的支架表面粗糙度及亲水性的提高,以及纳米层中含有的OH、NH2-生物活性基团能够促进骨间充质干细胞粘附和增殖。其次,诱导出的纳米层能够促进Ca-P矿化,有利于营养物质的吸附,进而促进骨间充质干细胞的分化及体内成骨。同时,诱导后的支架在808nm近红外光照射下,能实现快速升温,进而利用其良好的光热效果,能有效杀死肿瘤细胞,抑制裸鼠体内肿瘤生长。该成果已经申请专利一项,相关研究成果发表在《生物材料》(Biomaterials. 2016; 111: 138-148),第一作者为在读生马红石。该工作被《今日材料》(Materials Today)以新闻亮点形式报道。最近,该团队利用活性营养元素制备了超小尺度CuCoS2 纳米晶(~10 nm),其光热转换效率能达到73%,具有非常优良的光热效应,能有效杀死肿瘤,同时因为Cu等活性元素可以促进血管化,可能是一类新型的兼具“骨修复”与“肿瘤治疗”的双功能生物活性纳米材料(Adv Funct Mater 2017 DOI: 10.1002/adfm.201606218)。
此外,该团队还与同济大学合作,探索了细胞生物打印。该团队采用酶引发聚合温和的高强度超分子-高分子复合水凝胶与干细胞进行结合,通过原位3D打印,成功实现了干细胞在酶铰链的高强度水凝胶支架中的高效存活,为干细胞原位3D打印开辟了新方法(Chem Sci 2016;7:2748-2752)。
目前相关研究已经实现了部分技术转移转化,获得企业横向支持300余万元。相关研究工作得到了中组部青年千人计划、科技部重点研发计划、中科院青年拔尖人才以及国家自然基金支持。

图1. 3D打印制备的具有二硫化钼纳米片层的生物陶瓷多孔支架,支架具有优良的光热特性与成骨活性。纯陶瓷支架AKT(a)及不同二硫化钼含量的复合支架0.05MS-AKT(b)、0.1MS-AKT(c)及0.2MS-AKT(d)的形貌。
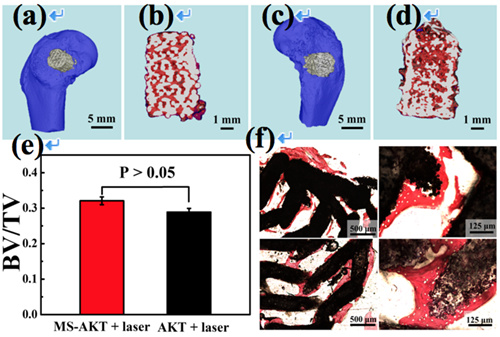
图2. 兔子股骨缺损部位植入3D打印的二硫化钼修饰的生物陶瓷支架(a,b)和纯陶瓷支架(c,d)八周后,在支架内部和周围形成大量新生骨组织(e,f)。
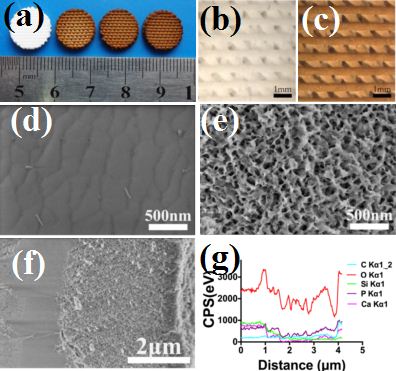
图3. (a)依次为纯生物陶瓷支架,2mg/mL, 4mg/mL, 6mg/mL 多巴胺诱导的生物陶瓷支架照片;纯生物陶瓷(b)和4mg/mL多巴胺诱导的生物陶瓷支架(c)的显微照片;纯生物陶瓷支架(d), 4mg/mL多巴胺诱导的生物陶瓷支架(e)的SEM结果;4mg/mL多巴胺诱导的生物陶瓷支架断面SEM(h)以及断面能谱(i)。
(责任编辑:admin)


 创想三维精彩亮相美国RAPI
创想三维精彩亮相美国RAPI 2019年中国技能竞赛“创想
2019年中国技能竞赛“创想 如何撬动消费升级带来的千
如何撬动消费升级带来的千 数字经济×千亿产业,催生
数字经济×千亿产业,催生 中南大学“创想杯”3D打印
中南大学“创想杯”3D打印 创想三维走进浙江科技学院
创想三维走进浙江科技学院 国际博物馆日,中
国际博物馆日,中 全球首例3D打印人
全球首例3D打印人 未来就是现在,工
未来就是现在,工

