修饰脂质纳米颗粒:实现软骨长效留存,助力骨关节炎与软骨缺损修复
骨关节炎(OA)会致使关节软骨逐渐退化,目前针对OA的早晚期均缺乏有效的治疗手段。软骨再生需要多种药物在损伤部位发挥作用并长时间留存,以招募内源性细胞,促进软骨形成。然而,关节腔内药物清除速度快,且软骨细胞外基质无血管、结构致密,这些因素成为药物输送的主要障碍,导致许多药物半衰期短,难以发挥疗效。同时,现有的纳米颗粒药物递送系统存在靶向性差、难以穿透软骨、载药量低等问题,在治疗早期骨关节炎和全层软骨缺损方面效果不佳。
北京航空航天大学生物与医学工程学院、生物力学与力生物学教育部重点实验室樊瑜波教授团队设计了一种软骨结合肽修饰的脂质纳米颗粒(CBP - ICMVs)作为药物载体,通过系统筛选多种靶向胶原II或软骨细胞的肽,确定了一种源自核心蛋白聚糖的肽修饰的纳米颗粒,其具有精准靶向和在软骨中长时间留存的能力。该团队还通过多层囊泡相邻脂质双层间的交联,提高了纳米颗粒的稳定性、载药量和双药持续释放性能。在大鼠OA手术模型和兔全层软骨缺损模型中,这种纳米颗粒能有效促进软骨再生。相关工作以“Bioinspired Lipid Nanoparticles with Prolonged Cartilage Retention Boost Regeneration in Early Osteoarthritis and Large Cartilage Defects”为题发表在《ACS Nano》上。 樊瑜波教授、王丽珍教授和侯森助理教授为该论文的共同通讯作者,第一作者为北航生物与医学工程学院的周瑾副教授、硕士研究生周悦和北医三院的王关卉儿博士。

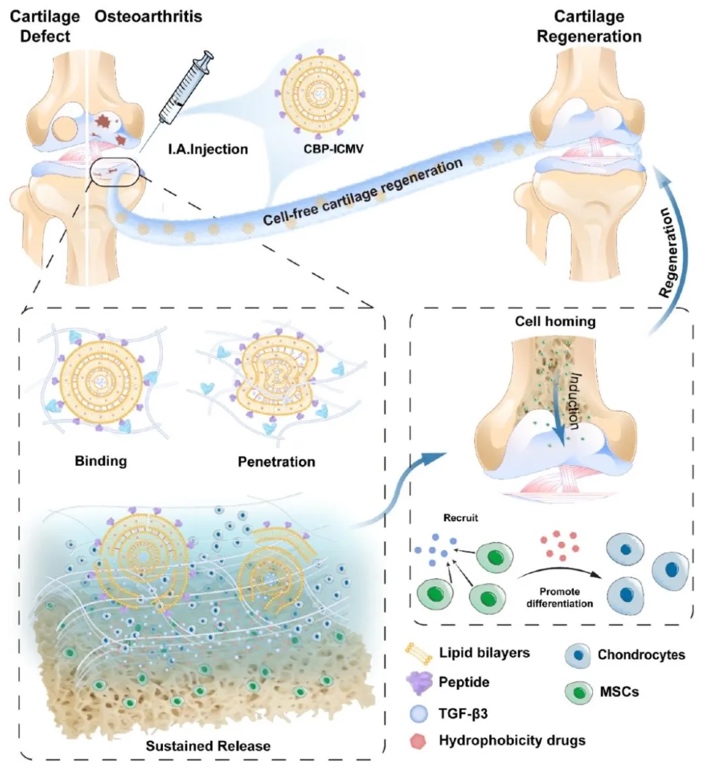
研究内容
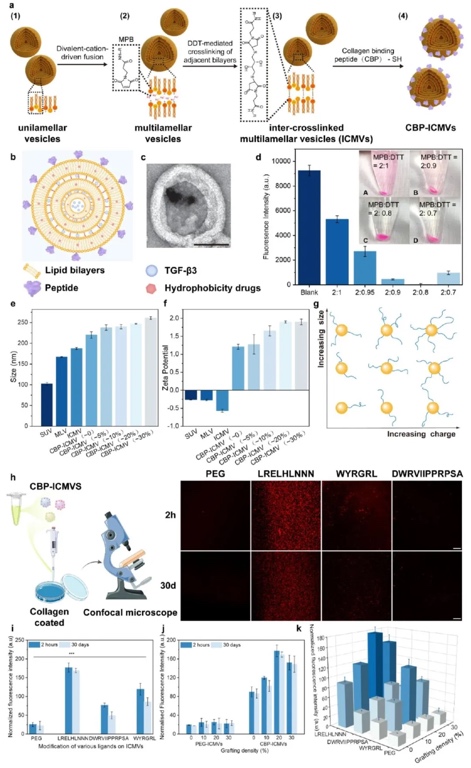
1. CBP-ICMVs的合成及物理表征:通过化学合成、透射电镜(TEM)、动态光散射(DLS)、ζ电位测定等方法,研究CBP-ICMVs的合成过程、结构、粒径、表面电荷以及不同肽修饰对其结合能力的影响。结果表明,成功合成CBP-ICMVs,其粒径随合成步骤逐渐增大,ζ电位变化证实了肽的成功共轭;不同肽修饰的ICMVs对胶原蛋白的结合能力不同,LRELHLNNN修饰的ICMVs结合能力最强,且20%的修饰密度时效果最佳。
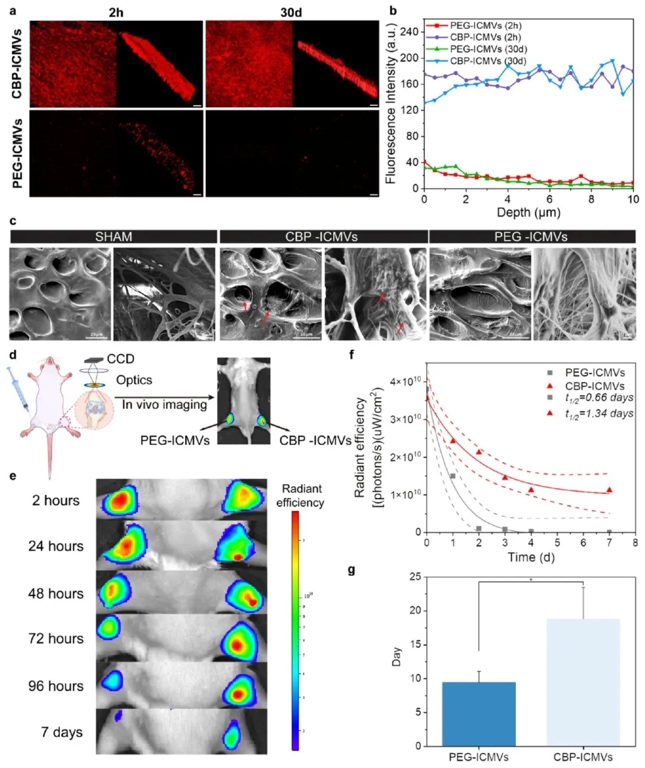
2. CBP-ICMVs在体外和体内延长软骨驻留时间并穿透软骨细胞外基质:运用共聚焦显微镜观察、扫描电镜(SEM)、体内成像系统(IVIS)等技术,以兔软骨切片和小鼠膝关节为研究对象,探究CBP-ICMVs的穿透和滞留能力。结果显示,CBP-ICMVs在体外能快速穿透并长时间滞留在软骨细胞外基质中,其荧光强度在2小时和30天时均显著高于对照的PEG-ICMVs;在体内,CBP-ICMVs在小鼠膝关节中的滞留时间明显长于PEG-ICMVs,关节内半衰期从0.66天延长至1.34天,提高了药物递送效率。
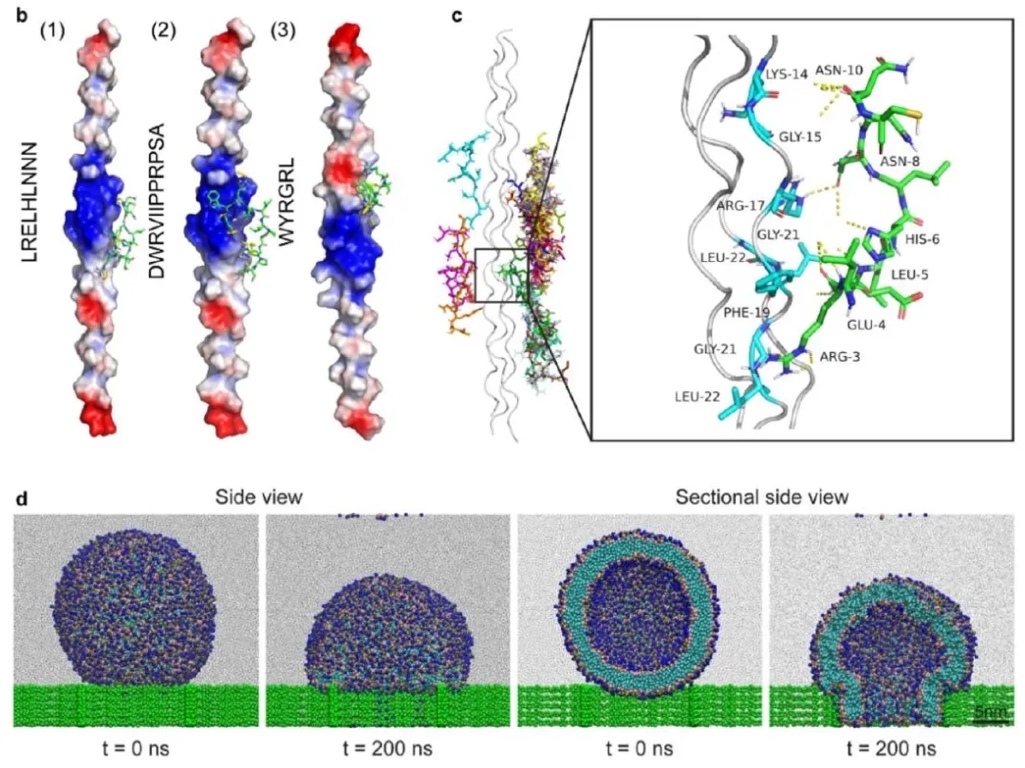
3. 人源II型胶原蛋白与三种选定肽的结合模式评估:采用分子对接和粗粒化分子动力学(MD)模拟的方法,研究三种肽(LRELHLNNN、DWRVIIPPRPSA、WYRGRL)与II型胶原蛋白的结合亲和力和结合模式,以及脂质体穿透软骨细胞外基质的能力。结果表明,LRELHLNNN与II型胶原蛋白的结合亲和力最高,为-7.7kcal/mol;MD模拟证实了脂质体可通过结构变形穿透比自身直径小的网格结构,验证了其穿透软骨细胞外基质的能力。
4. ICMVs负载药物的生物活性保留:通过测定不同阶段ICMVs对模型蛋白(BSA、TGF-β3)和疏水性药物(KGN)的包封率、药物释放动力学以及在不同环境下的稳定性,研究ICMVs对负载药物生物活性的保留能力。结果表明,ICMVs的载药量随合成步骤增加,对TGF-β3和KGN的包封率分别约为70%和39%;在37℃的PBS缓冲液中,ICMVs能显著延长药物释放时间,在模拟OA微环境中也表现出良好的稳定性。
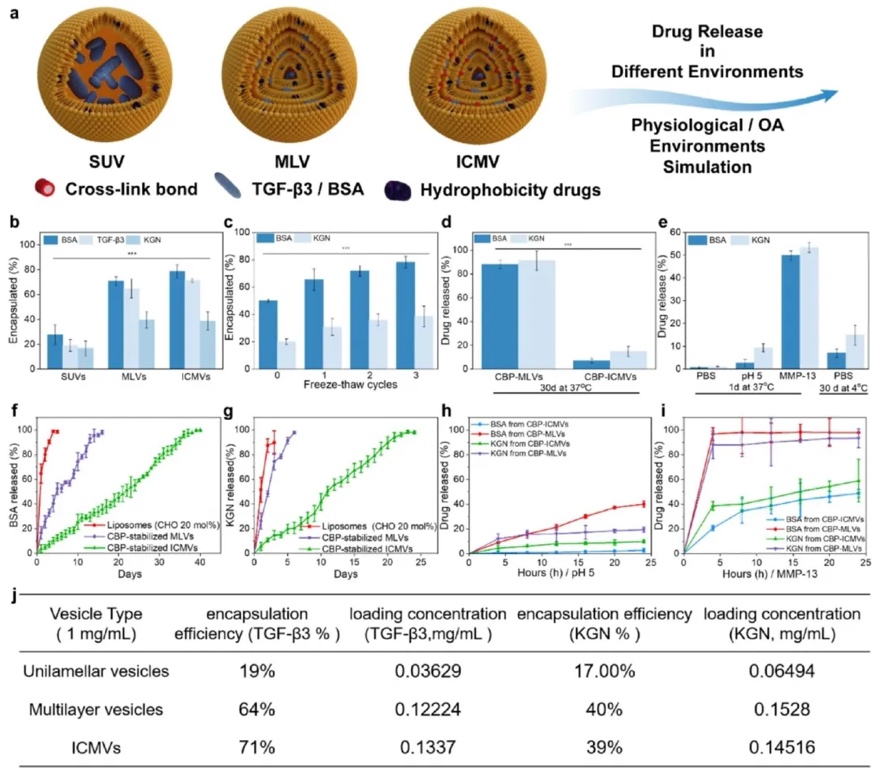
5. CBP-ICMVs负载KGN和TGF-β3促进MSCs体外向透明软骨分化:利用细胞培养、细胞化学染色、免疫细胞化学染色、RT-qPCR等技术,以人脂肪来源的间充质干细胞(hADSCs)为研究对象,探究CBP-ICMVs负载KGN和TGF-β3对MSCs向透明软骨分化的影响。结果显示,CBP-ICMVs负载KGN和TGF-β3的实验组(KT组),在细胞化学染色中产生更多的糖胺聚糖分泌,免疫细胞化学染色中II型胶原蛋白表达最高,RT-qPCR分析表明该组增强了软骨生成相关基因的表达,促进了MSCs向透明软骨分化。

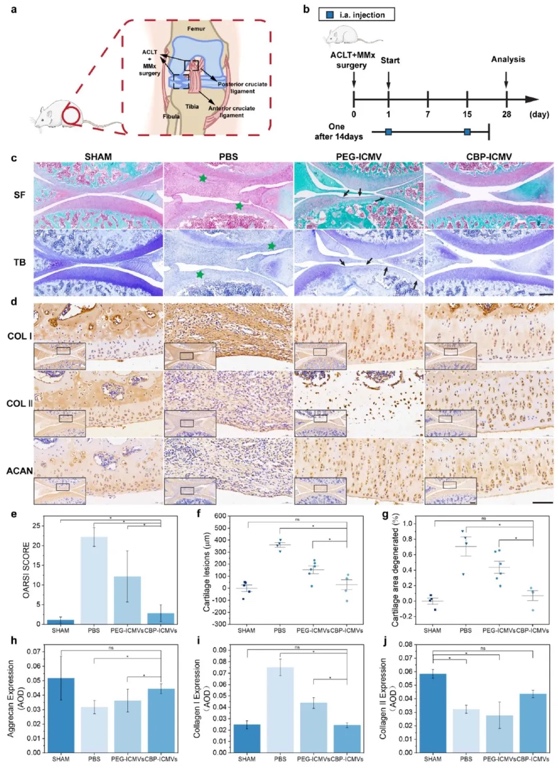
6. CBP-ICMVs负载KGN和TGF-β3减轻大鼠ACLT+DMM模型的软骨退化及治疗OA的能力:建立大鼠ACLT+DMM手术模型,通过组织学染色(HE、番红O、甲苯胺蓝)、免疫组织化学染色(Col I、Col II、Aggrecan)、OARSI评分等方法,研究CBP-ICMVs对早期OA的治疗效果。结果表明,与PEG-ICMVs组相比,CBP-ICMVs组的软骨损伤明显改善,软骨表面更光滑,Col II和Aggrecan的表达增加,OARSI评分更低,有效减轻了软骨退化,促进了OA的治疗。
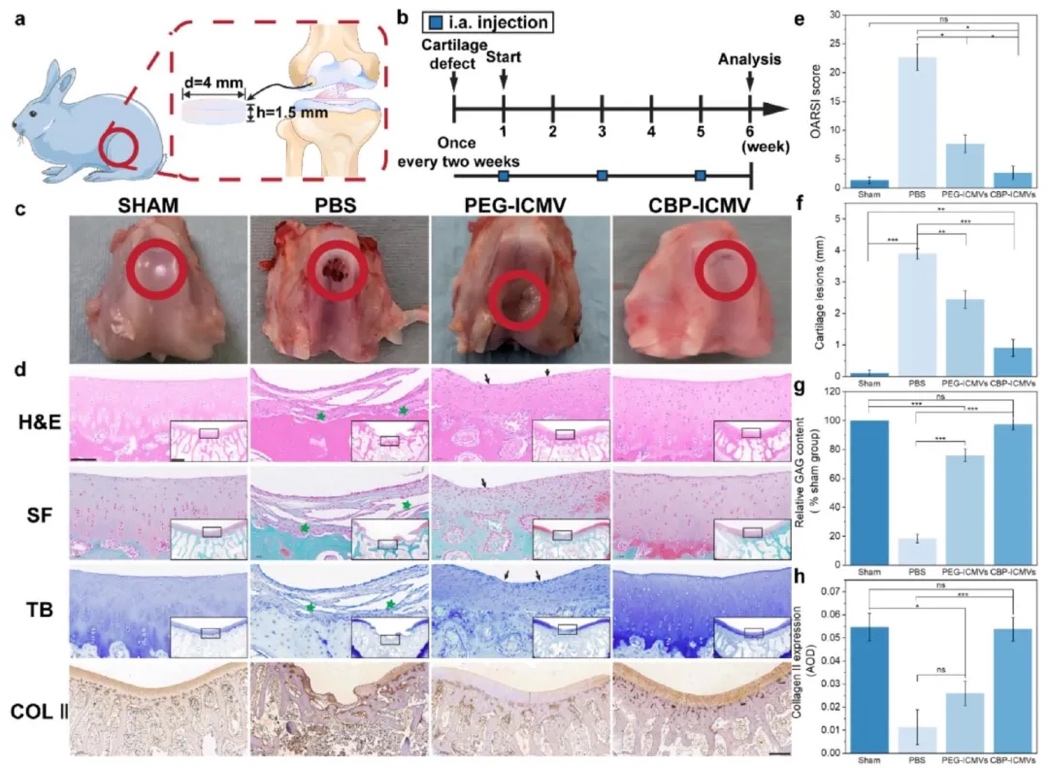
7. CBP-ICMVs负载KGN和TGF-β3修复兔模型软骨缺损:构建兔全层软骨缺损模型,运用组织学染色(HE、番红O、甲苯胺蓝)、免疫组织化学染色(Col II)、OARSI评分等方法,评估CBP-ICMVs对兔软骨缺损的修复能力。结果显示,CBP-ICMVs组的软骨缺损填充效果显著,修复的软骨组织与天然组织相似,番红O染色显示有更多的II型胶原蛋白形成,OARSI评分明显改善,表明其能有效修复全层软骨缺损。
研究结论
本研究表明,药物递送系统实现软骨修复再生的关键在于调控药物的时空分布和联合效应。体内评估显示,软骨缺损被类似透明软骨修复,组织学评估中软骨界面整合评分显著提高。释放的KGN和TGF-β3显著增强了软骨细胞的活力和增殖能力,增加了缺损界面修复组织的质量和数量,这意味着两种药物恰当的时空分布和联合效应有效调节了间充质干细胞的招募与分化。该结果说明,提高药物递送的准确性和有效性,有望为软骨缺损修复带来临床突破。未来,还可从以下方面进一步优化:一是增加功能恢复评估,如定量步态分析、负重对称性和疼痛相关生物标志物检测;二是探索其他生物活性因子与TGF-β3/KGN联合使用,协同促进透明软骨形成和软骨下骨重塑;三是过渡到大型动物模型,更准确地模拟人体关节的生物力学、缺氧微环境和免疫反应,严格评估软骨的长期完整性、机械弹性和宿主相容性。
文章来源:
https://doi.org/10.1021/acsnano.4c13828
(责任编辑:admin)
下一篇:没有了


 3D打印胶体气凝胶—材料世
3D打印胶体气凝胶—材料世 斯坦福大学团队:高延展物
斯坦福大学团队:高延展物 用于3D打印的阻燃和阻燃塑
用于3D打印的阻燃和阻燃塑 彩色3D打印线材介绍
彩色3D打印线材介绍 Axtra3D宣布与Additive Pl
Axtra3D宣布与Additive Pl nano3Dprint发布
nano3Dprint发布 3D Systems推出Ne
3D Systems推出Ne 3D打印超高强纳米
3D打印超高强纳米 UCLA郑小雨教授:
UCLA郑小雨教授: 意大利研究者研发
意大利研究者研发 Nature发表ZrO2-S
Nature发表ZrO2-S

