双水相嵌入(生物)3D打印构建无海藻酸、独立、可灌注的超细和超薄壁管状结构
时间:2023-02-09 15:48 来源:南极熊 作者:admin 阅读:次
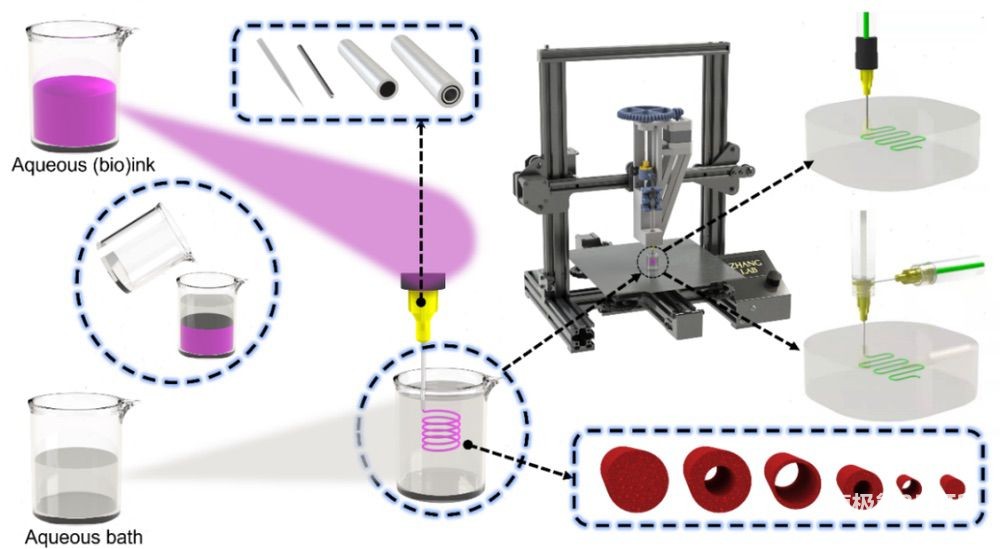
图 1. 通过双水相嵌入(生物)打印策略,打印无海藻酸、独立、可灌注的超细和超薄壁管状结构打印过程示意图。
研究者提出的双水相水下嵌入打印策略结合了双水相和同轴微流体生物打印技术,主要基于一种可光交联的甲基丙烯酰化明胶(GelMA)作为水性生物墨水,以及聚氧化乙烯 (PEO)作为水性支持浴。在一定浓度下,GelMA和PEO在形成的双水相系统中不相混溶,当调整两个水相的参数时,GelMA 生物墨水可以以嵌入的方式直接挤出到PEO支持浴中,打印形成稳定的3D图案。生物墨水不仅限于GelMA, 还包括透明质酸等。

图2. 优化、调节打印参数,使打印纤维能获得更大范围的尺寸可调节性。
使用此生物打印策略,通过调节喷嘴直径、墨水流量和打印喷头移动速度等打印参数,可以制备直径在10-700 μm之间的GelMA固体纤维(图2 A),这表明打印GelMA纤维具有简便性和强大的尺寸可调性。除了使用金属针作为喷嘴外,研究者还采用了玻璃毛细管来打印超细纤维,通过毛细管打印能够进一步优化GelMA纤维直径范围,可以制备从3 μm到60 μm的纤维(图2 B),这有利于进一步扩展组织生物制造的应用,因为通常情况下,均质水凝胶或颗粒状水凝胶被用作水下挤出打印的支持浴时,由于机械阻力较高通常无法顺利移动和打印出超细的纤维,而利用研究者提出的打印策略,玻璃毛细管可以在PEO为主体的水溶液支持浴中顺利移动和打印(图2 C-i)。此外,研究者展示了自制的、具有渐变尖端的超细玻璃毛细管也可以很容易地在PEO为主体的支持浴中从一侧转移到另一侧(图2 C-ii 上)。然而,在相同条件下,当使用凝胶支持浴时,沿毛细管路径的大量气泡被引入凝胶浴系统(图2 C-ii下)。总的来讲,双水相嵌入打印策略克服了迄今为止水下生物打印的一个普遍挑战。使用双水相策略与机械挤压方法相结合的另一个优势在于,它不仅允许重复修改打印图案,在使用动态配置的梯度浓度溶液作为支持浴时,还可以进一步实现形状可重构的四维(4D)打印。

图3. 表面化学交联诱导中空管状纤维的形成。
此外,由于研究人员能够实现在如上所述的PEO支持浴中直接打印GelMA纤维,他们设想通过表面交联方法制备壁厚可调节的中空管状纤维结构。基于此,研究者们创新性的提出采用微生物谷氨酰胺转氨酶(MTG)作为表面化学交联剂,通过四个步骤在PEO收集浴中生成管状结构(图3 A)。通过控制MTG交联时间,能够精确地调整管状结构的壁厚从10 μm到100 μm不等,直至形成固体水凝胶纤维(图3 B)。

图4. 同轴打印基于GelMA的管状结构。
传统同轴湿纺已被广泛用于高通量制备中空管状结构,基于此,同轴微流体生物打印方法也可以实现灌注管状结构图案的3D打印,正如研究者先前所报道的部分工作(Advanced Materials, 2018, 30, 1706913;Science Advances, 2022, 8, eabq6900)。然而,同轴挤压策略有两个关键限制。首先,它通常需要在海藻酸钠的存在下进行,海藻酸钠是一种可以通过二价阳离子(如Ca2+)物理交联的生物材料,以确保挤出过程中的快速成型。因此,海藻酸钠必须单独或混合作为生物墨水中的一种成分。一般情况下,除非经过化学修饰或制备后牺牲掉,否则海藻酸钠会限制细胞生长和伸展。尽管研究者最近证明,通过将明胶复合生物墨水挤出到冰水支持浴中可以制备不包括海藻酸钠的管状结构(ACS Biomaterials Science & Engineering, 2019, 5, 5514),但这无法解决第二个挑战。通常,同轴挤出的管状纤维的直径和壁厚保持在相对较大的尺寸上,所制备管状结构的内径无法轻易低于100 μm,壁厚最小为几十微米。即使研究者在之前的工作中提出了收缩打印法将内径减小到低于50 μm(Nature Communications, 2020, 11, 1267),但管壁厚度还是无法低于50 μm。毫无疑问,进一步减小管状结构内径和控制壁厚小于50 μm仍是一项巨大的挑战。为此,研究人员通过利用所提出的双水相嵌入同轴打印策略,证明了极大范围地调节管状结构直径和壁厚的可行性。研究者使用自制的双层同轴喷嘴,其中GelMA从壳层输送,而PEO从芯层共同输送到水性PEO支撑浴中,最终使用光交联固化后形成GelMA水凝胶管状结构(图4 A)。进一步,可以轻易地通过改变水凝胶的流量、打印喷头的移动速度等来调节管状结构直径和壁厚。研究表明,使用该同轴喷嘴可以获得传统的同轴湿法或生物打印设备中不可能实现的管状结构尺寸,例如内径最小可达37 μm、而壁厚最小可达4 μm(图4 B-E)。此外,为了说明超薄管壁的实际应用,研究者制备了不同壁厚的管状结构。使用自制的灌流装置分析了携氧红细胞在管状结构中氧气的扩散情况,结果表明,具有超薄壁特征的管状结构可以加速氧气的扩散,这也将适用于其他生物分子。这显示出了双水相水下嵌入同轴打印策略比传统同轴法打印的壁厚更能模拟毛细血管或小血管的物质传输。同时,研究者也进一步打印了由管状纤维组成的复杂三维结构(图4 F),这表明该打印策略能够完成复杂的3D结构的打印,利用该方法研究人员也成功打印了血管化的肿瘤组织模型。

图5. 同轴打印的管状结构内的细胞行为。
研究者随后开始评估双水相水下嵌入打印策略的细胞相容性。研究者设计了一种微流控芯片装置,将人脐静脉内皮细胞(HUVECs)接种到管腔内。细胞在接种后逐渐从圆形开始伸展,最后形成纺锤形(图5 A)。培养7天后,细胞活力高达98%(图5 A,图5 B-i)。在7天的培养过程中,HUVECs保持了很强的代谢活性,细胞铺展面积逐渐增加(图5 B-ii 和 iii)。 通过肌动蛋白染色,可以观察到培养第1天,细胞分布均匀,贴壁紧密,细胞生长和重组明显,在第7天后形成覆盖整个管腔内表面的致密单层结构(图5 C和D)。并且,在培养期间,内皮细胞在管状结构内表达出了明显的人紧密连接蛋白1(ZO-1,图5 E)。研究人员为了证明无海藻酸钠引入的优势,利用GelMA管状结构进行了萌芽诱导实验,结果证明与基于藻酸钠的管状结构不同,只有GelMA组成的管状结构很容易地被内皮细胞重塑、形成萌芽和多尺度血管化。这些结果表明,双水相水下嵌入打印策略制备的工程血管具有很好的细胞相容性,有利于内皮细胞生长、伸展、功能化和多尺度血管化的实现。实验过程中,研究人员分别使用人脐静脉内皮细胞和肾脏近曲小管上皮细胞进行了验证。

图6. 同轴打印的管状组织的宽尺寸可调整性。
具有大范围可调节的工程血管是成功复制血管结构和功能以用于转化应用的重要一步。传统的同轴微流体生物打印通常不允许形成具有超细直径或超薄壁的血管导管。研究者成功地在管状结构(直径从40到2000 μm,相应的壁厚从5到500 μm)的内腔表面接种了内皮细胞(图6),初步证明双水相水下嵌入(生物)打印策略具有灵活性,可以实现制备大范围、可调节的类血管结构。该打印策略打印的管状组织尺寸接近或完全覆盖人体血管尺寸,为满足不同类型应用的需求提供了可能性,特别是对于具有非常小直径和壁厚的血管尺寸的应用。
以上相关成果以 “Liquid-Embedded (Bio)printing of Alginate-Free, Standalone, Ultra-Fine, and Ultra-Thin-Walled Cannular Structures” 为题发表在《PNAS》上。文章通讯作者为Y. Shrike Zhang教授。文章第一作者为唐国胜(Guosheng Tang)教授,哈佛大学联培博士、博士后。论文共同第一作者为哈佛医学院Dr. Zeyu Luo、Dr. Liming Lian,其它作者还包括哈佛医学院Dr. Jie Guo、Dr. Sushila Maharjan、Carlos Ezio Garciamendez-Mijares、Prof. Mian Wang、Prof. Wanlu Li、Zhenrui Zhang、Dr. Di Wang、Prof. Maobin Xie、Prof. Hossein Ravanbakhsh、Dr. Cuiping Zhou、Dr. Xiao Kuang 和广州医科大学Dr. Yingying Hou、Prof. Xiyong Yu等。
原文链接:
https://www.pnas.org/doi/10.1073/pnas.2206762120
(责任编辑:admin)
最新内容
热点内容


 Xenia进军大幅面增材制造
Xenia进军大幅面增材制造 研究人员基于3D打印冰模板
研究人员基于3D打印冰模板 美国Brooks与惠普合作开发
美国Brooks与惠普合作开发 《AHM》:3D打印为患者定
《AHM》:3D打印为患者定 MB Therapeutics与Lynxter
MB Therapeutics与Lynxter 美国国防部正在使用3D打印
美国国防部正在使用3D打印 美国空军引进3D砂
美国空军引进3D砂 3D打印个性化晶格
3D打印个性化晶格 伊犁州奎屯医院实
伊犁州奎屯医院实 昆士兰科技大学3D
昆士兰科技大学3D 全彩3D打印吉他在
全彩3D打印吉他在 PSAS成功发射3D打
PSAS成功发射3D打

